P2-UE8-Entérobactéries

UE8 -De l’agent infectieux à l’hôte.
Date : 20-02-17 Plage horaire 14H-16H
Promo : P2 Enseignant : G. Miltgen
Ronéistes :
GAUTHIER Mathilde
PATEL Danial
LES ENTEROBACTERIES.
I. Les Entérobactéries
A. Introduction
B. Identification et caractères bactériologiques
C. Classification
D. Habitat
1. Chez l’homme
2. Dans l’environnement
E. Pouvoir pathogène
F. Diagnostic
G. Sensibilité aux antibiotiques
II. Différents groupes d’entérobactéries
A. E.Coli
B. Salmonella sp
1. Caractéristiques
A. Formes digestives
B. Formes septicémiques
C. Formes extra digestives
2. Diagnostic
A. Diagnostic direct
B. Diagnostic indirect
3. Traitement
4. Prévention
C. Shigella sp.
D. KES =Klebsiella sp. - Enterobacter sp. – Serratia sp. (autres
entérobactéries).
E. Proteus sp/ Providencia sp/ Morganella sp.
F. Yersinia sp.
III. Conclusion
Note: Il ne va pas nous piéger sur les petits détails. Retenir les grandes idées.
sur 129

Plan du cours = comment identifier les différents germes et quelles incidences le diagnostic
bactériologique a sur la prise en charge du patient.
But = savoir à quoi sert la bactériologie et surtout quel est l’impact quand on a un résultat à J-X
du prélèvement, quel est l’apport dans la prise en charge.
I. Les Entérobactéries.
A. Introduction
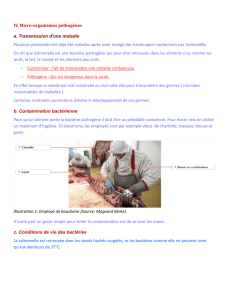
Les entérobactéries sont des bactéries commensales ou pathologiques du tube digestif de
l’homme et des animaux (entéro = intestin grêle).
Il existe 2 type de bactéries :
•Bactéries présentes en permanence dans le tube digestif qui peuvent devenir pathogènes
dans certaines conditions. E coli peut le devenir quand les défenses immunitaires ont
diminué.
•Bactéries qui sont tout le temps pathogènes (que l’on ne doit jamais avoir). Si la Salmonelle
est présente, le patient est symptomatique.
ATTENTION, bien distinguer les bactéries commensales et les bactéries pathogènes.
Elles sont très fréquentes en pathologie humaine :
•Elles représentent 2/3 à 3/4 des bactéries identifiées dans un labo de bactériologie.
•Certaines sont des pathogènes obligatoires (ex : shigelles). Dès leur entrée dans le tube
digestif, elles provoquent des maladies.
•D’autres présentent un caractère opportuniste, c’est à dire qu’elles sont soit commensales,
soit peuvent devenir pathogènes. Elles ne sont pathogènes qu’en quantité très importante sur
fond d’immunodépression.
D’autres groupes prolifèrent dans l’environnement (sols-eaux) et peuvent être une source de
contamination, notamment le groupe des Serratia.
Chacune de ses entérobactéries ont des caractères propre qui font qu’elles résistent plus ou
moins bien dans le milieu extérieur.
Ce sont des bactéries GRAM-. Les entérobactéries sont situées au premier rang dans l’infection
des bactéries GRAM-, à la fois en communautaire et à l’hôpital. Il y a environ 10^12 bactéries
par gramme de selles.
La plupart sont des bactéries anaérobies et parmi les anaérobies, les entérobactéries
représentent 10^3 bactéries par gramme de selles. Il y a différentes espèces et toutes n’ont pas
la même virulence et les mêmes applications en termes de pathologies.
Schéma (absent de la ronéo) : sur la gauche on a les pathogènes primaires (fréquent strict)
notamment les Salmonella, les Shigella, les Yersinia (qui sont des entéropathogenes qui donnent
de grandes symptomatologies digestives (diarrhées..). Parfois ils peuvent diffuser de manière
exceptionnelle en dehors du tube digestif et donner des septicémies.
Sur la droite on a les pathogènes opportunistes, les Providencia, les Morganella, les
Enterobacter, les Serratia, que l’on retrouve essentiellement à l’hôpital, souvent sur un terrain
sur 229

fragilisé.
On a des bactéries un peu à la frontière des deux : Escherichia coli, Klebsiella pneumonia,
Proteus. Ce sont des bactéries avec des facteurs de virulence certain, que l’on retrouve très
fréquemment en infections, notamment en communautaire pour E. coli.
B. Identification et caractères bactériologiques.
La famille des entérobactéries possède 7 caractéristiques communes :
•Bacille gram négatif (BGN) (couleur rose)
•Mobile (ciliature péritriche) ou immobile
•Non exigeants (poussent sur milieux usuel.
•Croissance en aéro-anaérobie falcutatifs (poussent à la fois avec et sans O2).
•Fermentent le glucose
•Nitrate oxydase (il dit reductase) : transformation possible des nitrites en nitrates.
•Oxydase négative.
Un examen direct se réalise sur un ECBU, sur un BV, ou sur par exemple une rupture
prematurée des membranes.!
PRINCIPE: Le prélèvement est sur le microscope et on regarde le microbe. L’examen se fait le
même jour de la réception du prélèvement. Quand il y a une culture qui pousse entre 18h a 24h,
à J1. L’antibiogramme est en général réalisé deux jour après, à J2.
Entérobactéries en forme de bâtonnets rose : GRAM négatif donnant cet aspect rosé. Souvent
on a une coloration bipolaire, c.à.d. que l’on a des bacilles un peu plus colorées aux extrémités
et clair au milieu. Cela permet parfois sur un examen direct de nous orienter vers la famille des
entérobactéries.
Comment identifie-t-on une entérobactérie (EB) au labo ?
•Examen Direct : Réalisé avec la coloration de GRAM ou l’état frais (on met juste un
prélèvement liquide sur une lamelle et on l’observe). Paramètres observables pour
l’entérobactérie : Bacille GRAM-, bipolaire, mobile.
Petite parenthèse sur ce qui se passe concrètement dans un laboratoire de bactériologie
On a 3 phases :
-Jour 0: arrivée du prélèvement
-Jour 1: premier jour de culture
-Jour 2 : réalisation d’un antibiogramme si nécessaire
Comme tout cela dure 48h, on a en clinique 2 traitements :
sur 329

-Le traitement probabiliste: on connait plus ou moins la bactérie impliquée dans la pathologie
mais on ignore sa sensibilité aux antibiotiques.
-Le traitement ciblé: on a eu un antibiogramme, ce qui permet de traiter le patient avec
l’antibiotique auquel la bactérie est sensible
•Caractères culturaux:
-Aspect de colonies grasses: lisses, bombées et brillantes
-Croissance rapide
-Type de milieux : milieux ordinaires et enrichis
-Atmosphère : O2 et sans O2
-Par exemple le « pseunomonase » poussera que en atmosphère O2
BUT : nous permettre de nous orienter vers l’identification de la bactérie.
A gauche : Culture sur gélose au sang
A droite : Culture en fonction des caractères
biochimiques des bactéries ce qui permet de les
colorer. Milieux dits chromogènes
•Caractères biochimiques:
-Grande diversité enzymatique et de fermentation des sucres (galerie d’identification, géloses
chromogènes)
-Fermentation de sucres (lactoses)
-Production d’indole
-Production d’uréase
-Production d’acétoïne (VP+)
-Utilisation du citrate
-Désamination du tryptophane (TDA)
Les caractères biochimiques sont aujourd’hui remplacés par la spectrométrie de masse
(MALDI-TOF). Chaque bactérie a une composition protéique spécifique, dans leur
cytosquelette, leur cytosol et leur membrane, elles possèdent des protéines qui leurs sont
propres.
PRINCIPE : Le Maldi-Tof casse la bactérie et envoie un laser pour ensuite faire un spectre. Le
spectre obtenu a des pics spécifiques de ses protéines. Il compare le résultat obtenu avec la base
de donnée, et ceux avec un indice très fiable ou non.
→ TRES FIABLE, RAPIDE, MOINS CHER.
•Caractères antigéniques:
-Peu utilisé maintenant
-Antigènes O pour la paroi :
-Toujours présents, thermostables, très toxiques (responsables de la toxicité,
endotoxine)… choc septique (fièvre, CIVD, bradycardie, hypotension…
-Permet de classer les EB d’une même espèce en sérotype ou sérovar (agglutination).
sur 429

-Mosaïque d’Ag, certains communs et certains spécifiques de chaque espèce,
fréquemment utilisés pour la détermination des sérotypes ou sérovars, parfois
diagnostic indirect (ex : sérologie Widal et Félix)
-Antigènes H pour les flagellaires :
-Thermolabiles
-Intérêt dans l’identification de certaines espèces comme la Salmonella
-Antigènes K pour les capsules ou l’enveloppe : (ex : Vi pour salmonella)
C. Classification.
•Il y a 4 grands groupes :
-Escherichiae : Les plus fréquentes sont E.Coli, Shigella, Salmonella qui ont beaucoup de
matériel génétique en commun, notamment E.Coli et Shigella. En MALDI-TOF on a
beaucoup de mal à les séparer.
-Klebsiellae: les plus fréquents sont Klebsiella, Entérobacter et Serratia (groupe KES).
Groupe n’ayant pas de tropisme particulier. A savoir que Raoutella est un cousin de
Klebsiella
-Protae : proteus, providencia, morganella
-Yersiniae : yersinia qui donne la peste.
sur 529
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%