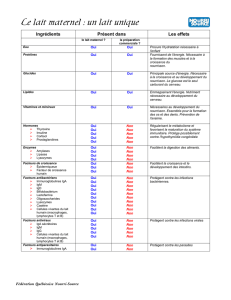
Induction des IgA contre les bactéries commensales

Hom
Homé
éostasie de l
ostasie de l’
’interface h
interface hô
ôte-commensaux:
te-commensaux:
furtivit
furtivité
é ou
ou tol
tolé
érog
rogé
én
nè
èse
se active ?
active ?
Leçon # 6:
Philippe
Philippe Sansonetti
Sansonetti
Chaire de Microbiologie et Maladies Infectieuses
Chaire de Microbiologie et Maladies Infectieuses

Mécanismes de tolérance au microbiote intestinal
Furtivité
1 - Faible reconnaissance des bactéries commensales
numériquement dominantes (Bacteroidetes et Firmicutes) et
Effet antiinflammatoire de certains commensaux.
2 - Maintien à distance des bactéries commensales (mucus,
molécules antimicrobiennes, barrière épithéliale, …)
3 - Diminution d’expression et/ou séquestration des TLR au
niveau des cellules épithéliales intestinales
Tolérogénèse active
4 - Induction de la tolérance au LPS
5 - Production d’IgA et compartimentalisation de la réponse
aux bactéries commensales
6 - Mécanismes de tolérogénèse active (T reg)

CD14 CD14
LPS-LBP
complexes
LBP
LPS
LBP
LBP
CD14
TLR4
Signaux pro-inflammatoires
MD-2
CD14
1 - Le lipide A des BG- anaérobies
commensaux (Bacteroidetes) sont
habituellement pentacylés, donc
faiblement agonistes, voire
antagonistes sur TLR4, contrairement
au lipide A hexacylé des BG- aéro-
anaérobies commensaux et
pathogènes (Munford & Varley, PLoS
Path., 2006).
2 - La phosphatase alkaline intestinale
(APase) de la bordure en brosse
détoxifie le lipide A et prévient
l’inflammation chez le Zebrafish en
réponse aux G- commensaux (Bates et
al., Cell host Microb., 2007).
3 - Peptidoglycanes ? Flagellines ?
APpase APpase
Stratégie de furtivité
Acyl-oxy-acyl
bounds Phosphorylations

Surface apicale
Surface latérale
Surface basale
Microvilli
Jonctions serrées
(claudins, ZO1,…)
Jonctions intermédiaires
(cadhérines,…)
Desmosomes
Gap junctions
Filaments
intermédiaires
Hémidesmosomes
Basale
Cellule épithéliale intestinale

Apomucines membranaires
Les apomucines épithéliales membranaires sont
synthétisées par l’ensemble des cellules épithéliales.
Elles possèdent toutes un domaine
transmembranaire.
EGF = Epidermal Growth Factor
SEA = Sea Urchin Sperm Protein Enterokinase Agrin
AMOP = Adhesion-associated domain
Gel de mucus
Mucines
membranaires
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%