Anatomie structurale et fonctionnelle des

L’Encéphale, 2006 ;
32 :
3-9, cahier 2
S 3
Anatomie structurale et fonctionnelle des ganglions de la base
J. YELNIK
(1)
(1) INSERM U679, Hôpital de la Salpêtrière, 47, boulevard de l’Hôpital, 75013, Paris. [email protected]
INTRODUCTION
Les structures sous corticales ou
Noyaux Gris Centraux
selon la définition anatomique classique constituent un
système aujourd’hui bien caractérisé sur le plan anatomi-
que et fonctionnel, le système des
ganglions de la base
.
La participation de ce système à la programmation, à l’ini-
tiation et au contrôle du mouvement est connue depuis
longtemps mais le rôle qu’il joue dans le contrôle des com-
portements émotionnels n’a été démontré que plus récem-
ment. La stimulation cérébrale profonde (SCP), mise au
point à Grenoble il y a 20 ans par l’équipe du Professeur
Benabid pour le traitement de pathologies motrices, a joué
un rôle déterminant dans cette démonstration. La pre-
mière application a été la SCP du noyau thalamique Vim
pour le traitement des tremblements. Puis les indications
se sont étendues à la maladie de Parkinson avec une pre-
mière cible située dans la partie postéro-ventrale du glo-
bus pallidus interne puis une deuxième, devenue la cible
de référence, située dans le noyau subthalamique (NST).
Dans cette présentation, nous utiliserons à la fois des
leçons apportées par la SCP de patients parkinsoniens et
dystoniques et des données récentes tirées de l’expéri-
mentation animale pour tenter de mieux comprendre com-
ment les ganglions de la base participent au contrôle des
comportements moteurs et émotionnels.
LES GANGLIONS DE LA BASE
ET LA STIMULATION CÉRÉBRALE PROFONDE
Les relations anatomo-cliniques
Une localisation très précise de l’électrode de stimula-
tion au sein de la cible choisie est l’un des éléments déter-
minants pour la réussite de l’intervention. Avec le recul, il
est possible d’évaluer la qualité de cette localisation sur
des séries rétrospectives de patients traités par SCP. Pour
cela, il faut pouvoir déterminer dans quelle structure céré-
brale chaque électrode a été implantée chez chaque
patient opéré. Plus encore, il faut pouvoir localiser chacun
des quatre plots que comporte l’électrode de stimulation
et parmi eux, celui qui a été choisi comme plot thérapeu-
tique par les cliniciens. Cette localisation peut se faire sur
la base des repères ventriculaires CA et CP et la hauteur
du thalamus, ou bien par recalage d’un atlas anatomique
avec l’IRM du patient. Cette méthode a l’avantage de four-
nir un niveau de résolution histologique, donc plus précis
que celui de l’IRM, mais il faut en même temps adapter
les tracés de l’atlas aux dimensions propres au cerveau
du patient. Pour cela, une méthode de recalage linéaire
semi-automatique a été développée qui permet d’adapter
l’atlas au cerveau en déterminant un facteur d’échelle
indépendant selon chacun des trois axes, en prenant des
repères visibles à la fois sur l’IRM et sur l’atlas histologi-
que.
Cette méthode a été appliquée à trois séries de
patients : 5 patients parkinsoniens traités par stimulation
pallidale (25), 10 patients parkinsoniens traités par stimu-
lation du NST (26) et 21 patients dystoniques traités par
stimulation du pallidum interne (24). Pour les deux pre-
mières séries, une très bonne relation entre le résultat cli-
nique et la localisation de l’électrode au sein de la cible a
été observée. Ainsi, la majorité des plots situés dans le
NST donnent de bonnes améliorations des symptômes
parkinsoniens alors que la majorité des plots situés hors
du NST donnent de mauvais résultats cliniques (26). Dans
le cas du pallidum (25), les plots qui améliorent l’akinésie
sont majoritairement situés dans le pallidum externe alors
que les plots situés dans le pallidum interne donnent de
mauvais résultats cliniques sur ce symptôme. Dans le cas
de la dystonie, les résultats ont été différents. Malgré une
très bonne localisation des électrodes au sein de la cible
visée, les résultats cliniques ne sont pas aussi bons pour

J. Yelnik L’Encéphale, 2006 ;
32 :
3-9, cahier 2
S 4
la dystonie que pour la maladie de Parkinson, pouvant
varier d’une amélioration de 100 % à une aggravation de
34 % (24). Cette variabilité des résultats de la stimulation
est à mettre en relation avec la variabilité symptomatique,
déjà connue, de la maladie dystonique elle-même.
Il apparaît donc que la maladie de Parkinson et la dys-
tonie, deux pathologies impliquant le même système des
ganglions de la base, réagissent de façon très différente
à la stimulation. L’interprétation de cette différence fait
appel, comme nous le verrons plus loin, à des niveaux
d’organisation différents du système.
Les effets non moteurs de la stimulation
La SCP, qui s’est largement développée en France puis
à l’étranger, a montré son efficacité et son innocuité pour
le traitement de pathologies motrices, en tout premier lieu
les tremblements, la maladie de Parkinson, la dystonie.
Dans le décours de ces traitements, des manifestations
non motrices liées à la stimulation ont été observées. Ainsi
un cas de dépression aiguë provoquée par la stimulation
de la substance noire (5), un cas de fou-rire provoqué par
stimulation du NST (14), un comportement agressif
déclenché pendant l’intervention par stimulation d’une
électrode d’exploration située médialement au NST (6),
des symptômes obsessifs compulsifs supprimés ou amé-
liorés par stimulation de la partie médiane du NST (15).
Ces cas individuels suggèrent qu’en dehors de ses fonc-
tions purement motrices, le système des ganglions de la
base est capable de traiter des informations non motrices
associées à des processus comportementaux plus com-
plexes. C’est à partir de cette constatation que la SCP a
été proposée pour le traitement de pathologies non motri-
ces telles que la maladie de Gilles de la Tourette (11) et
les troubles obsessifs compulsifs (protocole multicentri-
que français en cours).
L’interprétation de ces effets non moteurs fait appel à
un niveau d’organisation anatomique et fonctionnel parti-
culier des ganglions de la base sur lequel nous revenons
plus loin.
Il faut cependant noter que si ces effets non moteurs,
qui ont pu être observés dans des centres neurochirurgi-
caux différents, sont incontestablement provoqués par la
stimulation, tous les patients stimulés, et loin s’en faut, ne
présentent pas ce type d’effets même avec des électrodes
localisées exactement dans les mêmes sites topographi-
ques. Les réponses non motrices induites pas la stimula-
tion des ganglions de la base révèlent là aussi une grande
variabilité interindividuelle dans le domaine comporte-
mental.
L’ANATOMIE FONCTIONNELLE DES GANGLIONS
DE LA BASE
Dans le chapitre précédent nous avons vu que la SCP,
en plus de son utilité principale dans le domaine théra-
peutique, peut devenir un outil d’étude du fonctionnement
des ganglions de la base particulièrement instructif. Ainsi,
nous avons vu que les symptômes parkinsoniens ne réa-
gissent pas de la même façon que les symptômes dysto-
niques à la stimulation, nous avons mis en évidence une
caractéristique importante des ganglions de la base, la
variabilité symptomatique et thérapeutique, et nous avons
montré que les ganglions de la base sont impliqués dans
des processus non moteurs.
Un modèle de fonctionnement des ganglions de la base
peut-il expliquer à la fois ces différentes observations ? La
réponse est positive si l’anatomie des ganglions de la base
est analysée à trois niveaux organisationnels successifs :
connectivité, territoires fonctionnels et architecture neu-
ronale.
La connectivité des ganglions de la base
Il s’agit ici de prendre en compte la façon dont les dif-
férentes structures qui composent les ganglions de la
base sont connectées les unes aux autres et avec
l’ensemble du système nerveux.
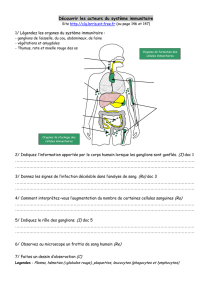
La
figure 1
montre les principaux circuits que compor-
tent les ganglions de la base selon un modèle devenu clas-
sique initialement proposé par Albin
et al.
(1). Un premier
circuit dit « voie directe » connecte le cortex cérébral au
striatum, puis au pallidum interne et à la substance noire
pars reticulata, et enfin au thalamus et au cortex frontal.
À côté de cette voie dite directe existe une « voie
indirecte » qui passe par le striatum, le pallidum externe
et le NST avant de projeter comme la voie directe sur le
pallidum interne et la substance noire pars reticulata, le
thalamus et le cortex frontal. En considérant le caractère
excitateur ou inhibiteur des différentes connexions
(figure 1)
, on comprend que dans l’état normal la voie
directe est activatrice, elle facilite le mouvement, alors que
la voie indirecte est globalement inhibitrice et a donc pour
effet d’empêcher le mouvement. Dans l’état normal, le
mouvement est favorisé par la dopamine synthétisée dans
la substance noire pars compacta et libérée dans le stria-
tum. En effet, la dopamine active les récepteurs D1 portés
préférentiellement par les neurones de la voie directe alors
qu’elle inhibe les récepteurs D2 portés principalement par
les neurones de la voie indirecte. Dans l’état parkinsonien,
l’absence de dopamine libère la voie indirecte inhibitrice
et n’active plus la voie directe activatrice, d’où une inhibi-
tion globale du mouvement
(figure 1)
.
Le modèle connexionniste (aussi appelé « boîte-
flèches ») des ganglions de la base permet donc de com-
prendre le principal symptôme de la maladie de Parkinson,
l’akinésie, comme un défaut de la balance normale entre
l’effet activateur du mouvement de la voie directe et l’effet
inhibiteur du mouvement de la voie indirecte. Il explique
également l’effet bénéfique de la SCP qui agit par inacti-
vation du NST donc par une réduction de l’hyperactivité
des noyaux de sortie (pallidum interne et substance noire
pars reticulata) qui libère ainsi le thalamus et le cortex en
permettant l’exécution du mouvement.

L’Encéphale, 2006 ;
32 :
3-9, cahier 2 Anatomie structurale et fonctionnelle des ganglions de la base
S 5
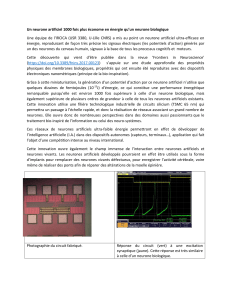
Les territoires fonctionnels des ganglions de la base
Les ganglions de la base peuvent être subdivisés en
trois territoires fonctionnels distincts en fonction de la topo-
graphie des régions du cortex cérébral qui projettent sur
les différentes parties du striatum
(figure 2)
. Ainsi, selon
le type d’information traitée dans chaque cortex, on dis-
tingue un territoire sensorimoteur qui traite des informa-
tions sensorimotrices, un territoire associatif qui traite des
informations cognitives, et un territoire limbique qui traite
des informations émotionnelles et motivationnelles (2,
18). Le territoire sensorimoteur provient des cortex moteur
primaire, prémoteur, moteur supplémentaire, oculomo-
teur et somesthésique et projette principalement sur le
putamen. Le territoire limbique provient des cortex orbi-
tofrontal, cingulaire antérieur et de l’hippocampe et pro-
jette sur la portion ventrale du striatum, le noyau accum-
bens. Le territoire associatif provient de la partie restante
des cortex frontal, pariétal, temporal et occipital et projette
sur la partie dorsale du noyau caudé. La validité de cette
subdivision territoriale a été clairement démontrée par des
expérimentations chez le primate. Sur le plan fonctionnel,
l’injection d’agents pharmacologiques a permis de déclen-
cher des mouvements anormaux de type dyskinétique
dans le territoire sensorimoteur, des troubles de l’attention
avec hyperactivité dans le territoire associatif et des sté-
réotypies dans le territoire limbique (9). L’injection de tra-
ceurs axonaux dans chacune de ces mêmes régions a
permis de confirmer la ségrégation anatomique de ces
trois territoires (8).
Le modèle territorial des ganglions de la base permet
donc d’expliquer comment la stimulation de certaines
localisations au sein des ganglions de la base peut avoir
des effets clairement moteurs alors que la stimulation
d’autres subdivisions peut se traduire par des modifica-
tions comportementales qui sont plutôt du domaine de la
psychiatrie.
L’architecture neuronale des ganglions de la base
L’architecture neuronale, dendritique et axonale, au
sein des ganglions de la base constitue un troisième
niveau d’organisation du système.
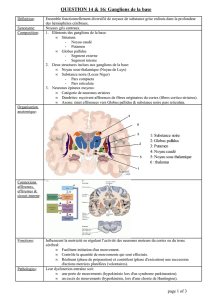
Sur le plan de la morphologie dendritique
(figure 3)
, les
neurones du striatum appartiennent à plusieurs espèces
neuronales très différentes morphologiquement (27). La
grosse majorité (96 %) est constituée des neurones épi-
neux. Ils portent des épines dendritiques sur lesquelles
font synapse les afférences corticales en provenance des
trois territoires fonctionnels. La base des épines reçoit les
synapses dopaminergiques qui sont ainsi en position stra-
tégique pour moduler l’effet de l’afférence corticale (22).
Parmi les autres neurones du striatum, les neurones cho-
linergiques (2 %) jouent un rôle capital dans le contrôle
des comportements motivés (13). Les neurones du palli-
dum ont une géométrie complètement différente de celle
des neurones épineux du striatum
(figure 3)
. Ils ne portent
pas d’épines, ont des dendrites extrêmement longues et
peu ramifiées et qui forment des disques aplatis disposés
perpendiculairement aux axones afférents en provenance
du striatum (28). La géométrie des neurones du NST et
du thalamus est plus proche de celle des neurones épi-
neux du striatum mais ils ne portent pas d’épines. Le cœur
des ganglions de la base est donc caractérisé par une rup-
ture de géométrie très importante entre le striatum et le
FIG. 1. —
Modèle connexionniste des ganglions de la base.
Le circuit direct prend son origine dans les neurones striataux
porteurs des récepteurs dopaminergiques D1. Le circuit
indirect prend son origine dans les neurones striataux porteurs
des récepteurs dopaminergiques D2. Les flèches noires sont
excitatrices, les flèches blanches sont inhibitrices. Dans l’état
normal (à gauche) la voie directe activatrice et la voie indirecte
inhibitrice s’équilibrent. Dans l’état parkinsonien (à droite),
l’absence de dopamine favorise la voie indirecte et freine la voie
directe, d’où une inhibition excessive du mouvement (akinésie).
GPe, pallidum externe, GPi, pallidum interne, SNr, substance
noire pars reticulata, SNc, substance noire pars compacta,
STN, noyau subthalamique, Th, thalamus.
CORTEX CEREBRAL
SNc
STN
GPe
D2 D1
STRIATUM
Thal Thal
CORTEX CEREBRAL
SNc
STN
GPe
D2 D1
STRIATUM
Gpi/SNrGpi/SNr
FIG. 2. —
Organisation territoriale des ganglions de la base.
Subdivision des ganglions de la base (vue sagittale à droite)
en trois territoires fonctionnels, sensorimoteur (SM), associatif
(AS) et limbique (LI) définis par leur origine corticale (vues
interne et externe à gauche).
SM
AS
LI

J. Yelnik L’Encéphale, 2006 ;
32 :
3-9, cahier 2
S 6
pallidum qui implique une convergence très forte en terme
géométrique mais aussi numérique (il n’y a qu’un neurone
pallidal pour cent neurones striataux) et volumique (le
volume du striatum est vingt fois plus grand que celui du
pallidum).
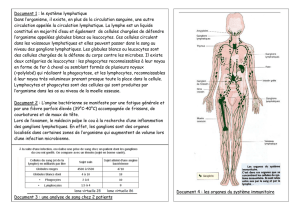
L’architecture axonale est elle aussi très particulière
(figure 4)
. Chaque axone striatal ne donne qu’un très petit
nombre de boutons synaptiques à chaque neurone palli-
dal qui reçoit ainsi ses afférences d’un grand nombre de
neurones striataux parfois très éloignés les uns des autres
(12, 29). Il reçoit ainsi une proportion, qui peut varier d’un
neurone à l’autre, d’informations motrices, associatives et
limbiques. L’ensemble des neurones du pallidum consti-
tue donc une représentation réduite, un échantillon, de
l’information corticale. La projection pallido-thalamique
est elle aussi très particulière. Chaque neurone pallidal se
termine en effet dans le thalamus par le moyen d’une série
de petits bouquets terminaux dont le nombre et la répar-
tition au sein du thalamus varie énormément d’un axone
à l’autre (3, 19).
Le modèle neuronal montre donc que l’information cor-
ticale afférente est soumise lors de son passage dans les
ganglions de la base à une restructuration complète par
compression numérique (dans le striatum et le pallidum),
modulation dopaminergique (dans le striatum également),
convergence géométrique (dans le pallidum), distribution
topographique variable (dans le thalamus).
LES GANGLIONS DE LA BASE
ET LA PROGRAMMATION DES COMPORTEMENTS
Le rôle que jouent les ganglions de la base dans la pro-
grammation et l’exécution des programmes moteurs ou
comportementaux porte sur plusieurs fonctions complé-
mentaires (4, 10, 16, 21) : apprentissage de séquences
comportementales nouvelles, mémorisation par compéti-
tion sous l’effet d’un renforçateur (la dopamine), sélection
sous l’effet d’une commande à point de départ cortical
frontal, exécution automatique sous l’effet facilitateur de
l’innervation dopaminergique. Mais comment réconcilier
des capacités fonctionnelles aussi élaborées (apprentis-
FIG. 3. —
Architecture dendritique des ganglions de la base. Dessins à la chambre claire d’un neurone pyramidal du cortex (CX),
d’un neurone épineux du striatum (ST), d’un neurone du globus pallidus (GP), d’un neurone du noyau subthalamique (STN) et d’un
neurone thalamo-cortical (TH). Les corps cellulaires et les arborisations dendritiques sont toutes représentés à la même échelle.
Les flèches indiquent les projections axonales. Le schéma de droite (ST-GP) montre les neurones épineux du striatum (petites
sphères) et les disques pallidaux disposés perpendiculairement aux axones striato-pallidaux sur une coupe frontale du striatum
(noyau caudé et putamen), du pallidum externe et du pallidum interne.
CX
b
e
c
a
l
p
ST
GP
TH
STN
ST-GP
200 µm

L’Encéphale, 2006 ;
32 :
3-9, cahier 2 Anatomie structurale et fonctionnelle des ganglions de la base
S 7
sage, mémorisation, sélection, exécution des tâches com-
portementales très complexes) avec une convergence anatomique qui semble réduire les possibilités de discri-
mination du système ?
Convergence pallidale
et apprentissage comportemental
Les très longues dendrites pallidales et leur disposition
par rapport aux axones striataux permettent de faire con-
verger sur un même neurone pallidal des informations pro-
venant de régions éloignées au sein du striatum (12, 29).
Le degré de convergence est en fait modulé par la dopa-
mine par un phénomène de focalisation dynamique (7) mis
en évidence dans son amplitude maximum chez le singe
rendu parkinsonien par injection du neurotoxique MPTP
(23). L’hypothèse proposée ici, l’hypothèse du clavier pal-
lidal, est que ce mécanisme est utilisé pour ajuster l’éten-
due de l’information afférente en fonction de la nature de
la séquence comportementale à exécuter. Une séquence
comportementale complète serait ainsi apprise, mémori-
sée et exécutée par une population spécifique de neuro-
nes pallidaux intégrant les informations sensori-motrices,
cognitives et limbiques appropriées à cette séquence*.
FIG. 4. —
Architecture axonale des ganglions de la base. Quatre neurones épineux du striatum (ST) avec leur axone et leurs
collatérales portant des varicosités présynaptiques faisant synapse avec les dendrites d’un neurone pallidal (GP). Chaque neurone
striatal ne donne qu’un petit nombre de varicosités et l’ensemble des boutions synaptiques que porte un neurone pallidal (environ
30 à 40 000) provient donc de nombreux neurones striataux différents. Le schéma de droite montre une coupe horizontale du pallidum
interne avec ses disques pallidaux et ses afférences provenant des trois territoires fonctionnels du striatum : limbique (LI), associatif
(AS) et sensorimoteur (SM). Certains neurones situés à la frontière entre deux territoires peuvent recevoir une combinaison
de deux types d’informations.
Clavier pallidal
LI
GP
ST
AS
SM
* Dans son ensemble, le pallidum constitue une sorte de clavier qui
reçoit l’ensemble de l’information corticale, certains neurones pal-
lidaux recevant leur information à partir de deux territoires fonc-
tionnels adjacents. La sélection de la sous-population de neuro-
nes correspondant à une séquence comportementale donnée
peut être vue comme la sélection, sur le clavier d’un piano, des
touches nécessaires à la réalisation d’un accord donné. Ainsi le
clavier pallidal permettrait d’exécuter une variété infinie de
séquences comportementales comme un clavier de piano permet
d’exécuter une infinité de pièces musicales différentes. Une fois
mémorisée sous l’effet dopamine-dépendant de la récompense,
une séquence donnée serait exécutée de façon automatique par
la population de neurones correspondante, à la demande d’un
chef d’orchestre cortical.
 6
6
 7
7
1
/
7
100%