Revue Chémoréflexes : de la physiologie à leur application pratique

Revue
Chémoréflexes :
de la physiologie à leur application pratique
Fabien Despas
1
, Olivier Xhaët
2
, Jean-Michel Senard
1
, Patrick Verwaerde
1
, Géraldine Jourdan
1
,
Daniel Curnier
1
, Michel Galinier
1,3
, Atul Pathak
1,3
1
Service de Pharmacologie Clinique, Inserm U 586, CESNA (Club d’étude du système nerveux autonome), Faculté de Médecine,
37 allées Jules-Guesde, 31073 Toulouse
2
Service de Cardiologie, Université Libre de Bruxelles, Hôpital Universitaire Erasme, Bruxelles, Belgique
3
Fédération du Service de Cardiologie, Pôle Cardiovasculaire et Métabolique du CHU de Toulouse, avenue Jean-Poulhès, 31000 Toulouse
Résumé.Les chémorécepteurs détectent les modifications des gaz sanguins (essentiellement hypoxémie et hypercapnie) et répondent par
une activation du système nerveux autonome sympathique et de la ventilation pour maintenir l’homéostasie cardiovasculaire et respiratoire.
Cette boucle est un déterminant majeur de la physiopathologie de certaines affections cardiovasculaires (hypertension artérielle, insuffisance
cardiaque) et de leurs conséquences (morbi-mortalité, mort subite). Ce réflexe est sous l’influence inhibitrice du baroréflexe et des afférences
thoraciques ; il est potentialisé par la survenue d’apnées nocturnes, le dysfonctionnement de ces facteurs explique en partie les anomalies des
chémoréflexes au cours des maladies cardiovasculaires. Cette revue précise la physiologie des chémorécepteurs, leurs rôles dans la genèse de
certaines maladies cardiovasculaires et leur importance tant dans le pronostic que comme cible thérapeutique.
Mots clés : chémoréflexes, système nerveux sympathique, ventilation, physiopathologie des maladies cardiovasculaires
Abstract.Chemoreflexes from physiology to practice. Chemoreceptors are able to detect both hypoxemia and hypercapnia. They respond
by increasing ventilation and the activity of the sympathetic nervous system. This loop is a key mechanism able to maintain homeostasis. This
reflex is inhibited by pulmonary afferents stretch and by baroreflex activation. Dysfunction of the chemoreflex per se or of inhibitory influences
is largely involved in the pathophysiology of various cardiovascular diseases as well as in their prognosis. These structures could thus also be
considered as therapeutic targets for new pharmacological agents.
Key words: chemoreflex, sympathetic nervous system, pathophysiology of cardiovascular disease
L’homéostasie cardiovasculaire et
respiratoire est en partie assurée
par des structures appelées chémoré-
cepteurs. Ces structures assurent la
détection des modifications des gaz
du sang (principalement hypoxie et
hypercapnie) et en réponse activent
des centres ventilatoires et cardiovas-
culaires.
Ces derniers sont responsables
d’une augmentation de l’activité sym-
pathique à destinée périphérique né-
cessaire pour restaurer des concentra-
tions normales en gaz du sang.
Le propos de cette revue est de
faire le point sur la physiologie de ces
structures d’interface entre les systè-
mes cardiovasculaires, respiratoires et
autonomes et de préciser leurs rôles
dans la physiopathologie de certaines
affections cardiovasculaires.
Anatomie et histologie
On distingue deux structures, les
chémorécepteurs centraux (dans le
tronc cérébral sensible à l’hypercap-
nie et l’acidose) et les chémorécep-
teurs périphériques (davantage sensi-
bles à l’hypoxie), ces derniers sont
localisés au niveau de l’arche aortique
et du glomus carotidien. Le glomus
carotidien (encore appelé corps caro-
tidien) forme une glande à sécrétion
interne de couleur grise rougeâtre,
d’un diamètre de4à5mm.Ilsesitue
en arrière de la bifurcation caroti-
dienne empiétant sur l’artère carotide
interne (figure 1). À ce niveau, le cali-
bre artériel augmente, formant une di-
latation fusiforme, le sinus carotidien,
et la paroi du vaisseau est plus élasti-
que, moins musculaire et surtout riche
en terminaisons nerveuses provenant
m
t
c
Tirés à part : A. Pathak
mt cardio 2006 ; 2 (3) : 321-7
mt cardio, vol. 2, n° 3, mai-juin 2006 321
Revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

des nerfs IX, X et comportant des fibres sympathiques. Les
corps carotidiens sont constitués de deux types cellulai-
res : les cellules chémoréceptrices dites glomiques (cellu-
les de type I) et les cellules sustentaculaires dites de sou-
tien (cellules de type II). Les cellules chémoréceptrices
dérivent de la crête neurale et ont dans leur cytoplasme
une population hétérogène de vésicules synaptiques
contenant divers neurotransmetteurs [1]. Ces amas de
vésicules se localisent en regard des terminaisons nerveu-
ses sensorielles (figure 2). Les cellules de soutien sont de
nature gliale et ne comportent pas d’organites spécialisés.
La proportion de cellules chémoréceptrices par rapport
aux cellules de soutien est de 4 pour 1. Ces groupes de
cellules forment des clusters qui se trouvent circonscrits
par un réseau dense de capillaires sanguins. La proximité
des capillaires permet la diffusion des gaz et métabolites
sanguins jusqu’à ces cellules. On note la présence d’une
innervation assurée par la branche carotidienne du nerf
glossopharyngien (1/3) qui contient un contingent à la fois
de fibres du système nerveux autonome (ortho- et para-
sympathique), de fibres sensitives (afférentes) et motrices
(efférentes). Les fibres efférentes et sympathiques sont à
destinée principalement vasculaire, en l’occurrence une
branche de la carotide externe, et participent à la régula-
tion du tonus vasculaire et de l’apport sanguin des corps
carotidiens (1/2, 1/3). Ceux-ci sont perfusés à haut débit
(2 L/mn/100 g), ce qui leur permet d’utiliser l’oxygène
dissous dans le sang et de ne pas dépendre de l’oxygène lié
à l’hémoglobine. Les corps carotidiens constituent des ré-
cepteurs toniques avec une fréquence d’émission basse
(moins de deux impulsions par seconde et par fibre, dans
des conditions physiologiques normales). La fréquence des
potentiels d’action est augmentée en présence d’une dimi-
nution de la pression partielle en O
2
ou bien après une
augmentation de la pression partielle en CO
2
ou du pH.
Physiologie et fonctionnement
du chémoréflexe
Le stimulus principal des chémorécepteurs périphéri-
ques est l’hypoxie et, surtout, la diminution de la pression
partielle en oxygène (PaO
2
), ce qui les rend peu sensibles
aux situations dans lesquelles le contenu artériel en oxy-
gène est diminué mais sans modification importante de la
PaO
2
(anémie, intoxication au monoxyde de carbone). La
détection de cette hypoxie est responsable d’une réponse
cardiovasculaire (tachycardie, augmentation de la pres-
sion artérielle) et ventilatoire (augmentation de la
fréquence respiratoire) sous la dépendance du tonus
Abréviations
AMP : adénosine monophosphate cyclique
H
2
CO
3
: acide carbonique
CO
2
: dioxyde de carbone
Na+ : natrémie
Ca+ : calcium
PaO
2
: pression partielle en O
2
HTA : hypertension artérielle
SAS : syndrome d’apnées du sommeil
NO : oxyde nitrique
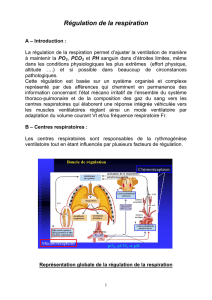
Figure 1.Augmentation de l’activité sympathique lors de l’administration de doses croissantes de dobutamine (rouge = placebo, bleu =
2,5 lg/kg/mn, vert = 7,5 lg/kg/mn) chez le volontaire sain au cours d’apnées volontaires. L’augmentation de l’activité sympathique
(neurogramme) a lieu pour une moindre diminution de la saturation en oxygène, suggérant une augmentation de la sensibilité des
chémorécepteurs périphériques. D’après Pathak et al.Br J Clin Pharmacology 2006 (in press).
Chémoréflexes : de la physiologie à leur application pratique
mt cardio, vol. 2, n° 3, mai-juin 2006
322
Revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

sympathique. Pour expliquer les mécanismes mis en jeu
par l’hypoxie au niveau des corps carotidiens, deux théo-
ries ont été avancées [2]. La première suppose qu’une
protéine sensible à l’oxygène associée à un canal potassi-
que (semblable à ceux retrouvés au niveau des cellules
endothéliales de l’artère pulmonaire) dépolarise dans des
conditions d’hypoxie les cellules chémoréceptrices. Cette
dépolarisation entraîne une entrée de calcium (à travers
l’ouverture de canaux calcique de type L) qui provoque la
libération de neuromédiateurs [3-5]. Il a été établi que,
parmi les neuromédiateurs impliqués, la libération de la
dopamine est proportionnelle à l’intensité de l’hypoxie,
cette réponse est corrélée avec l’activité électrique des
nerfs du sinus carotidien. L’importance de la voie du
calcium dans la genèse des réponses a été mise en évi-
dence dans des travaux in vitro sur des corps carotidiens
intacts. Ainsi, il existe une relation entre la PaO
2
et l’aug-
mentation d’AMP cyclique dans des conditions hypoxi-
ques. L’AMPc apparaît comme un modulateur puissant de
la sensibilité du canal K
+
à l’O
2
. L’addition de Forskolin
(un activateur de l’adénylate cyclase), de disobutylméthy-
lxantine (un inhibiteur des phosphodiesterase) ou du
dibutyryl-cAMP dans le milieu potentialise la libération de
dopamine à différents stimuli [6, 7].
La seconde théorie met en jeu une protéine à noyau
hémique (d’origine cytosolique ou mitochondriale), sen-
sible à l’oxygène, entraînant des réactions redox aboutis-
sant à la libération de neuromédiateurs. Les deux théories
ne semblent pas exclusives, les mécanismes mis en jeu
seraient mixtes, suivant le niveau de pression partielle
d’oxygène.
L’activation du chémorécepteur périphérique produit
une information modulée et véhiculée par voie nerveuse.
Ainsi, les fibres venant des nerfs glossopharyngiens (IX),
pneumogastriques (X) et du système sympathique chemi-
nent jusqu’aux corps carotidiens, ces afférences vont mo-
duler l’activité des corps carotidiens. Les fibres nerveuses
partant des corps carotidiens véhiculent les informations
jusqu’au niveau central, l’activation des corps carotidiens
engendre une stimulation des centres respiratoires respon-
sables d’une réponse réflexe afin de maintenir l’homéos-
tasie en oxygène.
Les chémorécepteurs périphériques sont également
sensibles à la concentration en ion hydrogène et en
dioxyde de carbone. Les mécanismes de stimulation des
chémorécepteurs périphériques par ces stimuli sont liés à
une augmentation de la concentration intracellulaire des
cellules glomiques en ion hydrogène, soit par diffusion
directe des ions hydrogènes, soit par la conversion du CO
2
en acide carbonique (H
2
CO
3
) rapidement dissocié en ion
hydrogène et en HCO
3-
. Les ions hydrogènes sont échan-
gés contre des ions sodium par une pompe Na
+
/H
+
et les
ions sodiums échangés à leur tour par des ions calcium
grâce à une pompe Na
+
/Ca
++
, ce qui entraîne une aug-
mentation de la concentration intracellulaire en calcium.
Cette augmentation de la concentration intracellulaire en
calcium provoque, encore une fois, l’exocytose des vési-
cules des cellules glomiques, riches en neuromédiateurs.
La dopamine ainsi libérée active de nouveau le réflexe
décrit précédemment.
L’intensité de la réponse des chémorécepteurs à ces
différents stimuli n’est ni identique ni linéaire. La réponse
la plus importante est obtenue en cas d’hypoxémie, et
particulièrement lorsque la PaO
2
devient inférieure à
70 mmHg.
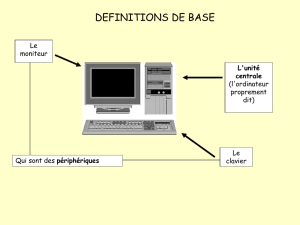
Chémorécepteurs centraux Chémorécepteurs périphériques
aortique et du glomus carotidien
Zone
chémosensible
Zone
inspiratoire
H+ + HCO3
CO2 + H2O
H2CO3
Figure 2.Anatomie des chémorécepteurs. D’après Guyton & Hall, Précis de physiologie médicale, Éditions Piccin, 2003.
mt cardio, vol. 2, n° 3, mai-juin 2006 323
Revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

La stimulation des chémorécepteurs se traduit par une
augmentation de la ventilation minute puis de la fré-
quence respiratoire. Les chémorécepteurs carotidiens sont
responsables de 90 % de la réponse ventilatoire à l’hy-
poxie et de 20 à 50 % de la réponse à l’acidose ou à
l’hypercapnie, qui restent des stimuli principalement pour
les chémorécepteurs centraux. Enfin, il existe d’autres
chémorécepteurs périphériques, situés sur l’aorte qui sont
mis en jeu lors d’un déficit chronique des corps caroti-
diens (tumeurs glomiques ou post-radiothérapie). De ma-
nière expérimentale, chez l’animal l’exérèse des corps
carotidiens ou bien la section bilatérale des nerfs contenus
dans les sinus carotidiens engendre une diminution de la
réponse ventilatoire dans des conditions d’hypoxie. Des
expériences menées chez le chat ont montré une récupé-
ration de 85 % de la réponse ventilatoire après 215-
260 jours d’une section bilatérale probablement sous l’in-
fluence de l’activité compensatrice des chémorécepteurs
situés dans l’aorte.
Physiopathologie cardiovasculaire :
interface chémoréflexe activité du
système nerveux autonome
La stimulation des chémorécepteurs entraîne une ré-
ponse ventilatoire et sympathique. L’augmentation de la
ventilation et l’activation cardiovasculaire périphérique
sous la dépendance sympathique (augmentation du débit
cardiaque, de la fréquence cardiaque et de la pression
sanguine artérielle) maintiennent l’homéostasie cardio-
vasculaire et respiratoire. L’augmentation de la réponse
ventilatoire inhibe à son tour l’activité des chémorécep-
teurs par le biais d’afférences pulmonaires. Enfin, l’activa-
tion sympathique contribue à une augmentation de la
pression sanguine artérielle qui stimule les barorécepteurs
artériels qui inhibent la fonction chémoréflexe, surtout en
réponse à l’hypoxie [8].
Les premières études portant sur la physiologie des
chémorécepteurs ont porté sur la réponse ventilatoire. Le
développement de la technique de microneurographie,
qui permet l’enregistrement de l’activité du système ner-
veux sympathique directement par enregistrement intra-
neuronal, a permis de s’intéresser plus précisément à la
réponse sympathique liée à l’activation des chémorécep-
teurs. On a ainsi pu mettre en évidence que, lors de
l’activation des chémorécepteurs par l’hypoxie ou l’hyper-
capnie, on observe une augmentation de la réponse ven-
tilatoire. Cette dernière, par l’étirement des afférences
thoraciques, inhibe la réponse sympathique induite par
l’activation des chémorécepteurs. Cette inhibition sympa-
thique est plus prononcée lors de l’activation des chémo-
récepteurs périphériques que centraux. Cette inhibition
s’explique par une relation entre les afférences thoraci-
ques et celles des chémorécepteurs périphériques dans la
région du tractus solitaire. Cette interrelation explique
que, lors des apnées, l’activation des chémorécepteurs
conduise à une potentialisation de la réponse sympathi-
que à destinée des vaisseaux musculaires et donc à une
vasoconstriction plus prononcée [9].
Le chémorécepteur périphérique est la seule structure
capable de simultanément activer le trafic sympathique
des vaisseaux périphériques et d’augmenter le tonus vagal
cardiaque. Ainsi, l’apnée en hypoxie entraîne des répon-
ses cardiovasculaires et autonomes caractéristiques du
réflexe de plongée, c’est-à-dire une activation sympatho-
vagale. En conséquence, durant la réalisation d’une ap-
née, l’augmentation de l’activité orthosympathique à des-
tiné vasculaire par l’hypoxie et/ou l’hypercapnie est
majorée [10]. La réponse à l’hypoxie et/ou à l’hypercapnie
varie en fonction des pathologies cardiovasculaires sous-
jacentes et explique leur physiopathologie, leur aggrava-
tion ou leur pronostic.
Hypertension artérielle
L’hypertension artérielle (HTA) s’associe à une aug-
mentation de la sensibilité des chémorécepteurs périphé-
riques. Ainsi, dans un modèle expérimental d’HTA chez le
rat, l’étude de la réponse ventilatoire à l’hypoxémie est
accrue par rapport au groupe témoin, alors que la réponse
à l’hypercapnie est sensiblement identique pour les deux
groupes. Lorsqu’on les expose à une hyperoxie (connue
pour inhiber l’activité des chémorécepteurs périphéri-
ques), ces mêmes animaux voient leur niveau tensionnel
se normaliser. Cette augmentation de la sensibilité des
chémorécepteurs pourrait en partie expliquer l’installa-
tion d’une HTA puisqu’une exposition à l’hypoxie pen-
dant 30 jours entraîne le développement d’une HTA ainsi
qu’une augmentation de l’activité du système nerveux
sympathique, là encore par une augmentation de l’activité
des chémorécepteurs périphériques [8, 11].
Des études chez l’homme suggèrent que les chémoré-
cepteurs périphériques ont une activité exagérée au cours
de l’HTA. Cela se traduit par une réponse ventilatoire à
l’hypoxie deux fois plus importante chez les sujets hyper-
tendus et ce sous l’influence d’une hyperactivité sympa-
thique. C’est au moment des apnées, quand l’influence
inhibitrice des afférences thoraciques est neutralisée, que
la réponse sympathique à l’hypoxie est particulièrement
prononcée. Cette hyperactivité sympathique est bien mise
en évidence chez des sujets hypertendus borderline où
elle peut être6à12fois plus importante que chez les
témoins. La présence d’un syndrome d’apnées du som-
meil (SAS) majore encore plus ce type de réponse sympa-
thique exagérée. Les liens entre HTA et SAS sont bien
établis, le SAS s’associe à une incidence accrue d’HTA et
l’inverse est vrai. L’activation des chémorécepteurs péri-
phériques est un des liens entre ces deux pathologies.
Chémoréflexes : de la physiologie à leur application pratique
mt cardio, vol. 2, n° 3, mai-juin 2006
324
Revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Syndrome d’apnées du sommeil
Les patients avec un SAS ont une réponse à l’hypoxie
accrue à un niveau comparable de celui des patients
hypertendus. Mais cette activation des chémorécepteurs
périphériques est visible, même chez des sujets normoten-
dus avec SAS. On retrouve ainsi des points communs entre
les sujets avec une HTA « limite » et ceux avec un SAS
sans HTA. Cette activation des chémorécepteurs périphé-
riques est spécifique et isolée puisque l’activité des ché-
morécepteurs centraux et la réponse au « test d’immersion
de la main dans l’eau glacé » (ou cold pressor test, test non
spécifique d’étude du système sympathique) sont inchan-
gées par rapport à des sujets témoins [12]. On sait que le
SAS s’associe fréquemment à l’obésité, mais la surcharge
pondérale n’explique pas l’activation des chémorécep-
teurs périphériques, puisque, chez des sujets obèses in-
demnes de comorbidités et de SAS, on observe une exa-
gération de l’activité des chémorécepteurs centraux sans
modification de la réponse à l’hypoxie [13]. Enfin l’hype-
ractivité des chémorécepteurs périphériques au cours du
SAS porte à la fois sur la réponse sympathique périphéri-
que mais également sur le tonus vagal à destinée cardia-
que. Ainsi, au cours de l’apnée, l’activation sympathique
et la prolongation de l’intervalle RR sont majorées par
rapport aux témoins [14].
La majoration de l’activité des chémorécepteurs péri-
phériques s’explique la nuit par l’exposition à des épiso-
des d’hypoxies intermittentes au cours des apnées. Mais
chez ces mêmes patients, on retrouve une majoration de
l’activité sympathique diurne alors même que les sujets
sont en normoxie. Cette observation suggère une augmen-
tation du tonus de base de l’activité des chémorécepteurs
périphériques. Pour preuve, l’exposition à l’hyperoxie, qui
inhibe l’activité des chémorécepteurs périphériques, en-
traîne une diminution de l’activité sympathique et de la
pression sanguine artérielle sans modification dans le
groupe témoin. Il semble que l’activation des chémoré-
cepteurs la nuit rende aussi compte du maintien de l’acti-
vité sympathique durant la journée et ce même en situa-
tion de normoxie.
Insuffisance cardiaque
L’insuffisance cardiaque se caractérise par une aug-
mentation du tonus sympathique. Plusieurs données sou-
lignent que cette activation neurohormonale précède
l’installation de l’insuffisance cardiaque symptomatique
[15]. Il est maintenant établi que les anomalies du système
nerveux sympathique contribuent à la progression de la
maladie et à son mauvais pronostic [15]. Jusqu’à présent,
ce sont les dysfonctionnements des baroréflexes artériels
et cardiopulmonaires (système inhibiteur de l’activation
sympathique) qui ont été incriminés dans la genèse de
l’hyperactivité sympathique [16]. Mais un grand nombre
de données expérimentales et humaines soulignent le rôle
prépondérant joué par l’activation des chémorécepteurs
(surtout périphériques) dans l’installation et la progression
de l’activation sympathique au cours de l’insuffisance
cardiaque.
L’étude du chémorécepteur périphérique chez
l’homme suggère que l’activation est proportionnelle à la
sévérité de la maladie (stade NYHA) et au type de cardio-
pathie (ischémique plus que dilatée) [17, 18]. Enfin, l’aug-
mentation de l’activité des chémorécepteurs périphéri-
ques est associée à une augmentation de la mortalité au
cours de l’insuffisance cardiaque [19]. L’administration
d’un mélange hyperoxique diminue l’activation sympathi-
que et la réponse ventilatoire, suggérant un rôle spécifique
de l’activation des chémorécepteurs périphériques. L’acti-
vation des chémorécepteurs périphériques est logique
lorsque l’hypoxie chronique est installée mais son instal-
lation précoce soulève un certain nombre d’interroga-
tions. Les données expérimentales suggèrent la modifica-
tion d’anomalies structurales au sein même des corps
carotidiens à l’origine d’une augmentation du tonus de
décharge de ces structures. Ces anomalies sont observées
à la fois dans des préparations intactes (perfusées) de corps
carotidiens mais également dans des préparations isolées,
ce qui confirme leur caractère intrinsèque [20]. L’une des
anomalies pourrait être la diminution de la production de
NO (agent inhibiteur de l’activité des chémorécepteurs)
dans les tissus concourant à une levée d’inhibition du
tonus des chémorécepteurs périphériques. La modulation
pharmacologique de la voie du NO par des antagonistes
(LNAME) et des substrats (L-arginine) ou donneur de NO
confirme cette hypothèse [20].
L’autre mécanisme responsable de l’hyperactivité des
chémorécepteurs périphériques repose sur l’interaction
entre le système des chémorécepteurs et le système des
barorécepteurs au niveau central ou ces deux systèmes
convergent dans le noyau du tractus solitaire. Ainsi, l’acti-
vation des chémorécepteurs périphériques supprime l’in-
hibition de l’activité sympathique par les barorécepteurs
et l’activation des barorécepteurs inhibe l’activation des
chémorécepteurs. L’interaction centrale et les dysfonc-
tionnements du baroréflexe pourraient expliquer l’aug-
mentation de l’activité des chémorécepteurs périphéri-
ques [21]. L’activation du chémorécepteur central reste
mal élucidée, l’hypothèse du rôle de la leptine, dont les
taux augmentent au cours de l’obésité et de l’insuffisance
cardiaque, pourrait en partie expliquer l’augmentation de
l’activité des chémorécepteurs centraux mais cette piste
demande à être confirmée [22].
Enfin, l’activation des chémorécepteurs centraux pour-
rait en partie s’expliquer par la prévalence accrue des
apnées du sommeil au cours de l’insuffisance cardiaque.
Les patients qui ont une réponse exagérée lors de l’admi-
nistration de CO
2
sont ceux qui ont le plus souvent un SAS
central. L’activation sympathique induite par les apnées
répétées chez l’insuffisant cardiaque contribue en partie
au maintien de l’activité sympathique et joue un rôle
mt cardio, vol. 2, n° 3, mai-juin 2006 325
Revue
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
1
/
7
100%