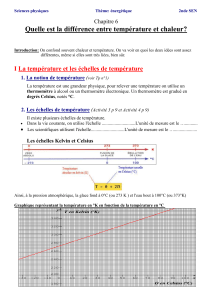
BATdef FICHE 5

FICHE N°5
Les unités de
mesures thermiques
FICHE 5
-
1
H
abituellement, pour affecter une valeur numérique à une grandeur physique, il suf-
fit de prendre une référence et de multiplier ou de diviser cette référence : par
exemple, une masse de 9,2 kg correspond à 9,2 fois la masse d’une référence de 1 kg.
Rien de tel pour la température : multiplier ou diviser une température n’a pas a priori
de signification physique évidente. De même pour additionner ou soustraire. Par exemple,
si on ajoute 1 litre d’eau à 20 °C et 1 litre d’eau à 30 °C, on n’obtient pas 2 litres à 50 °C.
Par cette caractéristique, la température est considérée comme étant une grandeur
intensive. Ceci veut dire que pour un système en équilibre, la température a la même
valeur pour le système entier que pour une partie quelconque. La pression constitue un
autre exemple de grandeur intensive. Parmi les unités de base du système international
d’unités (SI), la température est la seule grandeur intensive.
Mais au fait, qu’est-ce-que la température ? D’après la définition relevée dans un dic-
tionnaire encyclopédique, “la température est une grandeur traduisant la sensation de chaud
ou de froid.”
On reste un peu sur sa faim, surtout que la température fait partie des grandeurs phy-
siques que l’on est le plus souvent amené à mesurer. D’ailleurs, peut-on parler de mesu-
re ? Dans la littérature scientifique, on peut lire en effet que la température n’est pas une
grandeur mesurable. A défaut de mesure, on fait du repérage de température.
Du repérage à la mesure
On le sait depuis longtemps, toute variation de température provoque des modifica-
tions des caractéristiques physiques des matériaux... et c’est ce phénomène que l’on
exploite pour réaliser des thermomètres. La température dilate les solides, liquides et gaz
(exemple, le thermomètre à mercure), change la pression des gaz (thermomètre légal),
influence le rayonnement électromagnétique des corps (pyromètre optique), fait varier

Les unités de mesures thermiques
FICHE
5
-
2
la vitesse du son (thermomètre acoustique), modifie la valeur d’une résistance électrique
(thermomètre à résistance platine), génère des tensions électriques (thermomètre à ther-
mocouple), modifie la fréquence d’oscillation des quartz (thermomètre à quartz), etc.
On le voit, on n’a que l’embarras du choix.
A partir des variations thermiques de l’une des caractéristiques physiques d’un maté-
riau donné, on peut donc définir une échelle permettant de repérer des températures et
de constater l’égalité de deux températures. Cependant, une telle échelle est totalement
arbitraire, puisque liée à une propriété particulière d’un corps particulier : elle ne per-
met donc pas de donner à la valeur de la température une signification intrinsèque et
par conséquent, elle n’autorise pas sa mesure.
Heureusement, l’avènement de la thermodynamique au XIX
e
siècle a permis de déblo-
quer la situation et de définir des échelles de température ayant un caractère universel.
C’est en développant quelques considérations relatives au second principe de la ther-
modynamique que lord Kelvin établit en 1848-1849 la température thermodynamique
absolue qui porte aujourd’hui son nom. Il prouve en même temps l’existence du zéro
absolu, le même pour tous les corps.
Grâce à la thermodynamique, la température absolue représente autre chose qu’une simple
sensation de chaud ou de froid. Par exemple, le rapport de deux températures thermo-
dynamiques est égal au rapport de quantités de chaleur. Si on travaille avec des gaz par-
faits à volume constant, le rapport de deux températures thermodynamiques est égal au
rapport de deux pressions (loi de Boyle-Mariotte). On pourrait multiplier les exemples.
Ceci veut dire que toute température thermodynamique peut être définie à partir d’une
température de référence. Ainsi la température, d’abord purement subjective, a acquis
le statut de grandeur mesurable qui est attaché à la plupart des grandeurs physiques.
Quelques températures remarquables
Quelques températures de fusion de métaux
+ 231 °C : étain
+ 419 °C : zinc
≈660 °C : aluminium
+ 961 °C : argent
+ 1064 °C : or
≈1084 °C : cuivre
≈1535 °C : fer doux
≈1554 °C : palladium
≈1755 °C : platine
≈1800 °C : titane
≈3180 °C : carbure et titane
≈3410 °C : tungstène
Températures de chauffage de fours électriques, en fonction du type de résistance utilisé
≈1200 °C : nickel-chrome
≈1600 °C : platine
≈2800 °C : graphite sous pression
en atmosphère réductrice
≈3200 °C : tungstène sous pression
en atmosphère réductrice
Températures de combustion de gaz
≈1850 °C : gaz naturel + air
≈2850 °C : gaz naturel + oxygène
≈3200 °C : acétylène + oxygène
≈3650 °C : hydrogène + fluor
≈4550 °C : cyanogène + oxygène
≈5000 °C : butynedinitrile + oxygène

Les unités de mesures thermiques
Une première température de référence
Ceci étant, il aura fallu attendre... 1954 pour disposer enfin d’une définition légale de
l’unité de température thermodynamique. C’est en effet cette année-là que la 10
e
Conférence
Générale des Poids et Mesures (CGPM) a choisi le point triple de l’eau comme point
fixe fondamental en lui attribuant la température de 273,16 K. La 13
e
CGPM adopta en
1967 le nom de kelvin (symbole K) au lieu du degré kelvin (°K) en vigueur jusque-là et
formula la définition de l’unité de température thermodynamique comme suit :
Le kelvin, unité de température thermodynamique, est la fraction 1/273,16 de la tem-
pérature thermodynamique du point triple de l’eau.
Pour établir la température thermodynamique, on utilise la loi des gaz parfaits :
FICHE
5
-
3
NUMERO TEMPERATURE CORPS TYPE DE POINT
en kelvins en degrés Celsius
1 de 3 à 5 de – 270,15 He pression de vapeur saturante
à – 268,15
2≈13,8033 – 259,3467 e-H
2
point triple
3≈17 ≈– 256,15 e-H
2
(ou He) pression de vapeur saturante
(ou thermomètre à gaz)
4≈20,3 ≈– 252,85 e-H
2
(ou He) pression de vapeur saturante
(ou thermomètre à gaz)
5 24,5561 – 248,5939 Ne point triple
6 54,3584 – 218,7916 O
2
point triple
7 83,8058 – 189,3442 Ar point triple
8 234,3156 – 38,8344 Hg point triple
9 273,16 0,01 H
2
O point triple
10 302,9146 29,7646 Ga point de fusion
11 429,7485 156,5985 In point de congélation
12 505,078 231,928 Sn point de congélation
13 692,677 419,527 Zn point de congélation
14 933,473 660,323 Al point de congélation
15 1234,93 961,78 Ag point de congélation
16 1337,33 1064,18 Au point de congélation
17 1357,77 1084,62 Cu point de congélation
Points fixes de définition de l'EIT-90
Points fixes de l’Echelle Internationale de Température (EIT) adoptée en 1990, sous
l’appellation EIT-90. e–H
2
: hydrogène à composition d'équilibre des variétés ortho et para.
p.M
ρ= RT

Les unités de mesures thermiques
FICHE 5
-
4
où pest la pression, Mla masse molaire,
ρ
la masse volumique, Tla température absolue
et Rla constante des gaz parfaits : R= 8,3145 J.mol
–1
.K
– 1
.
Le thermomètre idéal est donc un thermomètre à gaz parfait. Hélas, les gaz parfaits
n’existent pas. Cependant, il y a une solution. Les gaz parfaits résultent en effet d’une extra-
polation aux très basses pressions des gaz réels. Il suffit alors d’utiliser des gaz réels...
et faire ensuite des corrections.
Ce n’est pas pour autant que le problème est résolu. Les thermomètres à gaz ont en
effet de gros inconvénients : entre autres, ils sont encombrants et difficiles à utiliser par
le commun des mortels.
Une échelle avec des points fixes de référence
Pour simplifier la vie courante, la Conférence Générale des Poids et Mesures de 1927
a déterminé une Echelle Internationale de Températures (EIT). Cette échelle, qui en est
à sa cinquième révision, détermine un certain nombre de “points fixes” qui sont, en quelque
sorte, des températures parfaitement reproductibles.
90
t- t (°C)
68
90
t(°C)
-200 0 200 400 600 800 1 000
0,4
0,2
0
-0,2
90
t- t (°C)
68
–200 0 200 400
0,04
0,02
0
–0,02
–0,04
L’EIT-90 présente quelques différences avec l’EIPT-68 utilisée depuis
1968. Dans les applications “pointues”, il faut en tenir compte.

Les unités de mesures thermiques
FICHE 5
-
5
L’échelle actuellement en vigueur est l’EIT-90 et elle comprend 17 points fixes. Tous cor-
respondent à des états d’équilibre entre deux ou trois phases (liquide, solide, vapeur) de
substances pures. Le point fixe le plus connu est évidemment (puisque c’est celui de la
définition du kelvin) le point triple de l’eau : il correspond au point d’équilibre entre les
phases solide, liquide et vapeur. Ce point est obtenu à la pression de 101 135 Pa et, par
définition, à la température de 273,16 K.
Le but de l’Echelle Internationale de Température est de définir des procédures d’éta-
lonnage et d’utilisation de thermomètres dont les qualités de reproductibilité ont été
reconnues. Chacun des thermomètres couvre un domaine de l’Echelle et il est étalonné
aux points fixes qui se trouvent dans le domaine qu’il couvre.
L’EIT va plus loin. Pour chacun des thermomètres choisis, elle donne en effet la loi
mathématique qui permet d’établir une correspondance entre les indications fournies
par le thermomètre et les températures thermodynamiques. Ceci permet de faire une
interpolation entre les points fixes.
Dans l’EIT-90, le thermomètre utilisé entre 0,65 K et 5 K est le thermomètre à pression
de vapeur d’hélium. De 3 K à 26 K, on fait appel au thermomètre à gaz. Dans la gamme de
14 K à 962 K, l’instrument spécifié est le thermomètre à résistance de platine. Au-dessus
de 962 K, on fait appel à une mesure de rayonnement (selon la loi de Planck) par pyro-
mètre optique.
On le voit, ces domaines se recouvrent. Si tout était parfait, dans les zones de recou-
vrement, les indications données par les deux thermomètres concernés devraient être iden-
tiques. Ce n’est hélas pas le cas, même si les écarts sont minimes. Pour améliorer l’EIT,
il faut continuer de travailler sur le sujet et parfaire la connaissance scientifique et tech-
nique.
Ceci étant, on a fait beaucoup de progrès et l’EIT-90 apporte des améliorations tan-
gibles à l’EIPT-68 utilisée auparavant. Les valeurs des points fixes ont été redéfinies et
de nouveaux points fixes ont été introduits afin que les valeurs de température soient désor-
mais en accord avec les valeurs thermodynamiques. Les formules mathématiques d’inter-
polation ont été revues de façon que dans les zones de recouvrement, les thermomètres
fournissent des indications très voisines. Autres améliorations, l’EIT-90 permet de des-
cendre jusqu’à 0,65 K tandis que l’utilisation du thermomètre à résistance de platine a été
poussée jusqu’au point triple de l’argent (961,78 °C) et remplace de ce fait le thermo-
couple (type S) utilisé jusqu’ici.
L’établissement de l’échelle EIT-90 nécessite de corriger les tables numériques associées
aux thermocouples et aux thermomètres à résistance de platine. Il faudra en faire de
même pour toutes les tables donnant des spécifications (de matériaux, de pression de vapeur,
par exemple) en fonction de la température. Les modifications sont cependant minimes,
et, pour bien des applications, la précision habituellement requise ne nécessite pas une
remise en cause de l’échelle.
 6
6
 7
7
 8
8
1
/
8
100%