Les dosages hormonaux dans la prise en charge et le monitorage

Les dosages hormonaux dans la prise en charge
et le monitorage des cycles d’assistance
médicale à la procréation :
intérêt et difficultés de réalisation
J. Taieb
C. Benattar
C. Poüs
Service de biochimie et d’hormonologie,
Hôpital Antoine Béclère, Clamart
Article reçu le 4 novembre 2002,
accepté le 21 février 2003
Résumé. Le dosage des hormones de la reproduction tient une place très
importante au cours des différents protocoles d’assistance médicale à la pro-
création (AMP). Avant la prise en charge des patientes, un bilan hormonal
comprenant un dosage de FSH, estradiol, LH, et inhibine B est réalisé au début
d’un cycle menstruel normal. Il est défini pour chacun de ces paramètres un
seuil décisionnel qui permet d’évaluer la qualité de la réserve folliculaire
ovarienne et de prévoir le résultat de la tentative d’AMP. Par ailleurs, au cours
des différents protocoles d’AMP, des dosages sériés d’estradiol, progestérone
et LH permettent d’évaluer le recrutement et la croissance folliculaire, d’ajus-
ter quotidiennement le traitement de chaque patiente et de programmer le
déclenchement de l’ovulation. Nous analysons ici l’intérêt de chacun de ces
paramètres et discutons les difficultés d’interprétation des résultats résultant de
la mauvaise standardisation des techniques de dosages.
Mots clés : endocrinologie de la reproduction, estradiol, progestérone, LH,
FSH, inhibine B, AMH
Summary. In assisted reproductive technology (ART), serum levels of several
key hormones are used to evaluate ovarian follicular reserve and to monitor
gonadotropin-stimulated follicle growth. Currently, serum estradiol, FSH, LH
and inhibin B levels are examined and combined at the beginning of the
menstrual cycle to evaluate the functional status of the ovaries, providing
information for appropriate ovarian stimulation treatment and prognosis for
in vitro fertilization (IVF) outcome. In women undergoing in vitro fertilization
and embryo transfer (IVF-ET), ovulation stimulation is monitored by serial
measurements of estradiol, progesterone and LH to monitor follicular growth,
evaluate the progression of stimulation, adjust daily gonadotropin therapy for
each patient, and predict the optimal day for the induction of ovulation. We
analyze the importance of each hormone and discuss the discrepancies fre-
quently reported resulting from differences in methods.
Key words: reproductive endocrinology, estradiol, progesterone, LH, FSH,
inhibin B, AMH
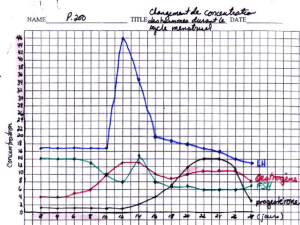
Au cours des cycles d’assistance médicale à la procréation
(AMP), les dosages hormonaux jouent un rôle prépondé-
rant. Avant la prise en charge en AMP ils permettent d’éva-
luer la réserve folliculaire ovarienne et de proposer aux
patientes la meilleure alternative, c’est-à-dire celle qui
donnera le meilleur résultat. Actuellement, les principales
hormones qui rendent compte du potentiel ovarien sont la
FSH (follicle stimulating hormone), l’estradiol, la LH (lu-
teinizing hormone), l’inhibine B et l’AMH (hormone anti-
müllérienne). Par ailleurs, au cours des différents protoco-
les d’AMP les dosages hormonaux sont utilisés pour
Tirés à part : J. Taieb
revue générale abc
Ann Biol Clin 2003, 61 : 533-40
Ann Biol Clin, vol. 61, n° 5, septembre-octobre 2003 533
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

évaluer le recrutement et la croissance folliculaire, ajuster
quotidiennement le traitement de chaque patiente et pro-
grammer le déclenchement de l’ovulation. En effet, le mo-
nitorage de l’ovulation est important, au cours des cycles
sans ponction d’ovocyte (programmation d’une insémina-
tion intra-utérine, de relations sexuelles ou du replacement
d’un embryon cryopréservé) et au cours des cycles stimu-
lés (qui associent aux inducteurs de l’ovulation un ago-
niste ou un antagoniste de la GnRH (gonadotropin re-
leasing hormone) dans le cadre de la fécondation in vitro
et transfert d’embryon (Fivete). Les différentes hormones
nécessaires à ces évaluations sont l’estradiol, la progesté-
rone et la LH. Nous proposons dans cette revue de définir
l’intérêt de chacun de ces paramètres et de discuter les
difficultés d’interprétation des résultats. Ces problèmes
sont essentiellement liés à la multiplication des techniques
de dosage et à leur manque de standardisation.
Évaluation de la réserve ovarienne
Différentes approches peuvent permettre d’évaluer la ré-
serve folliculaire ovarienne de la patiente de manière à
prévoir la qualité ovocytaire [1].
L’échographie
Effectuée au début du cycle menstruel, elle permet de
visualiser le nombre de follicules antraux susceptibles
d’être recrutés au cours de la stimulation [2].
Le bilan hormonal
Le but du bilan hormonal est d’essayer de classer les
patientes afin de choisir le protocole d’AMP le plus appro-
prié. Cependant, seule la réponse ou non à la stimulation
confirmera ensuite la pertinence du choix. Il est réalisé au
tout début de la phase folliculaire d’un cycle menstruel (j3
ou j4). Il comprend actuellement le dosage de quatre hor-
mones : FSH, estradiol, LH et inhibine B. Les concentra-
tions obtenues sont plus discriminantes que l’âge de la
patiente [3-5]. Une autre molécule, l’AMH, peut égale-
ment rendre compte de la réserve folliculaire ovarienne.
FSH
Une élévation de la FSH, malgré la présence de cycles
réguliers, est connue en péri-ménopause et chez les patien-
tes ayant des échecs répétés en FIV. Elle est associée à une
diminution du taux de grossesses évolutives [1, 6]. Sa
concentration à j3 du cycle menstruel semble bien refléter
l’âge physiologique des ovaires [3] ; elle est fortement
corrélée au nombre de follicules antraux visibles à l’écho-
graphie (r = 0,29 ; p < 0,001) [7]. Cependant, le dosage de
la FSH pose un certain nombre de problèmes liés aux
fluctuations observées d’un cycle à l’autre chez une même
patiente [6, 8], à la complexité structurale des glycoprotéi-
nes, à l’existence d’un important polymorphisme physio-
logique (pour la FSH il existe au moins vingt isoformes
circulantes différentes) et à la spécificité des immunodosa-
ges qui sont tous de type sandwich, avec au moins un
anticorps monoclonal (et parfois deux) reconnaissant tout
ou partie de la FSH circulante. Enfin, les discordances
entre techniques [9] peuvent résulter également de problè-
mes d’étalonnage, car malgré l’existence d’un étalon inter-
national de FSH, les réactifs sont calibrés avec des étalons
secondaires dont la concentration est corrélée à l’étalon
international, et des facteurs de correction permettent le
calcul des résultats. Cette variabilité peut être illustrée par
les résultats des différents contrôles nationaux de qualité
français dont un exemple est présenté dans la figure 1 [10].
Par ailleurs, une étude réalisée dans une population de
femmes jeunes et fertiles désireuses de participer au pro-
gramme de don d’ovocytes de notre centre d’AMP, nous a
permis de montrer que les résultats obtenus, pour le do-
sage de la FSH à j3 du cycle, par six techniques de dosage,
sont statistiquement différents [11]. Le tableau I présente
les méthodes de dosage étudiées, le nombre d’échantillons
analysé et les résultats obtenus.
Estradiol
L’équipe de Licciardi a été la première à s’intéresser à
la valeur prédictive de l’estradiol au troisième jour du
cycle. Elle montre qu’une concentration > 220 pmol/L
(> 60 pg/mL) est associée à une diminution du nombre
d’ovocytes et que, quel que soit l’âge de la patiente, il n’y
a pas de grossesse quand l’estradiolémie à j3 est
> 275 pmol/L (> 75 ng/mL) [4]. Ce dosage est aujourd’hui
réalisé par différentes techniques directes et automatisées
assez mal corrélées entre elles [12-14] et pour lesquelles
on observe une importante dispersion des résultats
(figure 1). Elles ont été mises au point pour le suivi des
Tableau I. Comparaison des moyennes et des écarts-types (DS)
pour la FSH à j3 du cycle menstruel dosée chez une population
de femmes jeunes et fertiles, par six méthodes d’immunoanalyse
(d’après [11])
Méthode n Plage de
concentration
(mUI/mL)
Moyenne
(DS)
(mUI/mL)
Elecsys 2010 (Roche Diagnostics) 77 3,2-17,4 8,8
a
(3,0)
FSH Coatria
125
I (Bio-Mérieux) 82 3,1-15,8 6,5
a
(2,2)
Advia-Centaur (Bayer Diagnostics) 99 3,4-18,4 6,8
b
(2,7)
Architect i2000
(Abbott Laboratories)
129 3,6-21,5 8,2
b
(3,3)
Vitros Eci
(Ortho-Clinical Diagnostics)
133 2,8-19,8 6,9
b
(3,0)
ACS-180 (Bayer Diagnostics) 215 3,4-20,8 7,6
a, b
(3,0)
Le test de t-apparié de Student a été effectué entre ACS-180/Coatria
125
I, ACS-
180/Elecsys 2010, Coatria
125
I/Elecsys 20010 ; a < 0,001 et ACS-180/Vitros ECi, ACS-
180/Architect i2000, ACS-180/Advia-Centaur, Vitros Eci/Architect i2000, Advia-
Centaur/Architect i2000 ; b < 0,001.
revue générale
Ann Biol Clin, vol. 61, n° 5, septembre-octobre 2003534
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

cycles stimulés (concentrations élevées). Elles présentent
généralement une bonne linéarité mais manquent de sensi-
bilité [15] pour le dosage des concentrations basses. En
effet, la limite de détection analytique, généralement four-
nie par le fabricant, est définie dans les conditions idéales
du dosage en dosant plusieurs fois le calibrant zéro
(moyenne des signaux obtenus plus deux écarts- types).
Elle est souvent utilisée par les biologistes mais elle ne
correspond pas à la véritable limite de quantification des
dosages. Cette dernière, appelée sensibilité fonctionnelle,
est déterminée à partir du profil de précision de la techni-
que comme étant la plus petite concentration qui donne un
coefficient de variation inter-série égal à 20 % [16]. Nous
avons réalisé un travail comparant les limites de détection
analytiques et les sensibilités fonctionnelles de neuf tech-
niques de dosage directes de l’estradiol [15]. Les résultats
obtenus sont présentés dans le tableau II. Ils montrent
qu’il existe une importante différence entre les deux limi-
tes. En conséquence, il peut être nécessaire de définir les
seuils décisionnels à j3 du cycle, car ils peuvent être très
différents d’une technique à l’autre [13, 14]. Cette diffé-
rence peut être illustrée par une étude concernant l’évalua-
tion du dosage de l’estradiol sur l’Architect i2000, le nou-
vel automate d’immunoanalyse commercialisé par la
société Abbott, qui nous a permis de montrer que la valeur
pour le seuil décisionnel à j3 du cycle est < 405 pmol/L
(< 110 pg/mL) et non pas < 220 pmol/L (< 60 pg/mL)
comme définie pour la technique de dosage que nous utili-
sons en routine dans notre laboratoire [17].
LH
Dans ce bilan, l’intérêt du dosage de la LH est de mettre
en évidence, soit une concentration élevée (avec un rap-
port LH/FSH supérieur à 2), qui signe une dystrophie
ovarienne plurifolliculaire, soit une concentration très
basse (< 1 mUI/mL) qui est un facteur prédictif d’insuffi-
sance ovarienne [18]. Le dosage de cette hormone est
soumis aux mêmes difficultés que celles évoquées ci-
dessus pour le dosage de la FSH (complexité structurale,
polymorphisme physiologique avec plus de trente isofor-
mes circulantes, spécificité et calibration des immunodo-
sages) La variabilité inter technique est illustrée par un
exemple de contrôle national de qualité présenté dans la
figure 1. Pour éviter d’éventuels problèmes d’interpréta-
tion des résultats, il est conseillé d’utiliser pour le dosage
de la LH et de la FSH des techniques commercialisées par
un même fabricant.
FSH IA26 : toutes techni
q
ue
s
LH IA26 : toutes techni
q
ue
s
Pro
g
es
t
é
rone IA26 : toutes techni
q
ue
s
Estradiol IA26 : toutes techni
q
ue
s
U
I
/
L
U
I
/
L
p
mol/
L
Figure 1. Histogrammes des résultats du contrôle national de qualité pour des valeurs basses de FSH, LH, estradiol et progestérone
(Annales du contrôle national de qualité 1999 ; 16 : 76-82).
Dosages hormonaux et AMP
Ann Biol Clin, vol. 61, n° 5, septembre-octobre 2003 535
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Inhibine B
Dans l’ovaire, cette hormone essentiellement produite par
les cellules de la granulosa des follicules non lutéinisés,
est un inhibiteur de la production de FSH qui joue un rôle
essentiel dans la régulation de la sélection folliculaire. Son
dosage en début de cycle permet d’évaluer la capacité
sécrétoire ovarienne [19-21]. Sa concentration est forte-
ment corrélée au nombre de follicules antraux (r = 0,29 ;
p < 0,001) [7]. Une concentration basse (< 45 pg/mL) est
associée à une mauvaise réponse à la stimulation et à une
diminution des taux de grossesses. À l’inverse, une
concentration > 45 pg/mL signe une bonne réserve ova-
rienne et permet de prévoir une bonne réponse à la stimu-
lation [22]. Pour le dosage spécifique de cette hormone, il
n’existe qu’une seule technique commercialisée [23]. Il
s’agit d’une technique manuelle de type Elisa. Cela sou-
lève le problème du monopole mais présente l’avantage de
disposer d’un seul seuil décisionnel.
L’AMH
L’AMH (hormone antimüllérienne) appelée MIS (Mülle-
rian inhibiting substance) par les Anglo-Saxons, est pro-
duite par les cellules de la granulosa ovarienne des follicu-
les immatures. Très récemment, il a été montré que cette
hormone peut rendre compte de la réserve folliculaire ova-
rienne. Elle pourrait prochainement prendre une place pré-
pondérante dans le bilan hormonal de pré-inclusion en
AMP. En effet, il a été récemment montré que sa concen-
tration à j3 du cycle, est très fortement corrélée (r > 0,70 ;
p < 0,0001) au nombre de follicules antraux visibles à
l’échographie [7] et qui seront recrutés au cours de la
stimulation [24]. De plus, la concentration d’AMH à j3 du
cycle diminue avec l’âge de la patiente [25]. Le dosage de
cette hormone est réalisé par une technique Elisa ultrasen-
sible (commercialisée par la société Beckman-Coulter)
dont les qualités analytiques (notamment la sensibilité
fonctionnelle) permettent l’utilisation de ce marqueur pour
l’évaluation de la réserve folliculaire ovarienne. Cepen-
dant, aucune étude n’a actuellement défini de seuil déci-
sionnel à j3 du cycle.
En résumé, le tableau III présente les différents types de
profil et les pronostics associés en fonction des résultats
des dosages de FSH, estradiol, inhibine B, LH obtenus à
j3 du cycle menstruel [26]. Par ailleurs, pour pallier les
fluctuations observées au cours de différents cycles chez
une même patiente, ce bilan est souvent réalisé au cours
de plusieurs cycles successifs [6, 8]. En effet, nous avons
pu mettre en évidence, chez une cinquantaine de patientes
prélevées au cours de trois cycles successifs, des fluctua-
tions inter-cycles voisines de 40 % pour l’estradiol, 18 %
pour la FSH et 13 % pour l’inhibine B (données non pu-
bliées). Enfin, ce bilan peut être complété par des dosages
de prolactine, testostérone, androstènedione et TSH.
En conclusion, l’interprétation du bilan hormonal, réalisé
avant la prise en charge des patientes en AMP, soulève des
problèmes liés à la variabilité des techniques de dosage.
Tableau III. Bilan hormonal à j3 du cycle menstruel, pronostic de
la réponse à une stimulation ovarienne et profil de la patiente
(d’après [26])
FSH
(mUI/L)
LH
(mUI/L)
E2
(pmol/L)
Inhibine B
(pg/mL)
Réponse à la stimulation,
profil de la patiente
< 5 < 6 < 165 > 45 Bonne réponse, patiente
« normo-répondeuse »
> 10 > 6 > 220 < 45 Mauvaise ou non-réponse,
patiente en péri-ménopause
> 10 < 6 < 165 > 45 Réponse si stimulation adaptée,
patiente en insuffisance
ovarienne débutante
> 10 < 6 > 165 < 45 Non-réponse, patiente en
insuffisance ovarienne sévère
< 10 < 6 > 275 < 45 Non-réponse, patiente en
insuffisance ovarienne sévère
< 5 > 6 > 165 > 45 Bonne réponse, patiente
présentant un syndrome d’ovaire
plurifolliculaire, de bon pronostic
< 5 > 6 > 165 < 45 Non-réponse, patiente
présentant un syndrome d’ovaire
plurifolliculaire, de mauvais
pronostic
Tableau II. Limites de détection et sensibilités fonctionnelles déterminées pour neuf dosages d’estradiol (E2) et huit dosages de
progestérone (P) (d’après [15])
ACS-
180
Advia-
Centaur
Architect
i2000
Axsym Coatria
125
I
Elecsys
2010
Immuno-1 IMX Kryptor Vitros
ECi
E
2
: limite de détection pmol/L (pg/mL) 33
(9)
33
(9)
77
(25)
ND 26
(7)
37
(10)
33
(9)
73
(20)
11
(3)
48
(13)
E
2
: sensibilité fonctionnelle pmol/L (pg/mL) 110
(30)
110
(30)
169
(46)
ND 73
(20)
62
(17)
55
(15)
144
(40)
20
(5,5)
59
(16)
P : limite de détection nmol/L (ng/mL) 0,48
(0,15)
0,32
(0,10)
< 0,32
(< 0,1)
0,54
(0,17)
0,16
(0,05)
ND 0,32
(0,10)
ND 0,19
(0,06)
0,48
(0,15)
P : sensibilité fonctionnelle nmol/L (ng/mL) 1,43
(0,45)
1,27
(0,40)
0,64
(0,20)
0,80
(0,25)
0,48
(0,15)
ND 0,57
(0,18)
ND 0,32
(0,10)
1,11
(0,35)
ND : non déterminé ; E
2
: facteur de conversion en unités internationales ; × 3,67 ; P : facteur de conversion en unités internationales ; × 3,18.
revue générale
Ann Biol Clin, vol. 61, n° 5, septembre-octobre 2003536
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.

Chaque laboratoire doit donc définir, pour ses dosages de
FSH, d’estradiol et de LH, les seuils décisionnels à utiliser
à j3 du cycle menstruel.
Les tests de stimulation
Il s’agit de tests de « réserve ovarienne » qui permettent de
quantifier la réponse ovarienne obtenue durant un laps de
temps très court, après l’administration d’un inducteur de
l’ovulation (mesure de l’estradiolémie et/ou de la FSH
et/ou de l’inhibine B avant et après l’administration de
l’inducteur). Plusieurs molécules peuvent être employées :
le citrate de clomiphène [27], les agonistes de la GnRH
[28] ou la FSH [29]. Ces tests sont assez peu utilisés pour
exclure certaines patientes du cadre de l’AMP, mais ils
constituent un argument pronostique intéressant pour ju-
ger de l’opportunité de la poursuite des traitements. En
revanche, l’analyse de la réponse à une stimulation précé-
dente (nombre d’ampoules d’inducteur utilisé, durée de la
stimulation pour l’obtention des critères de déclenche-
ment, concentration d’estradiol le jour du déclenchement)
constitue un bon moyen d’évaluer la réserve ovarienne.
Monitorage de l’ovulation
Dans les cycles d’AMP, les dosages hormonaux sont très
importants pour le monitorage de l’ovulation. Ils sont uti-
les pour la programmation d’une insémination intra-
utérine, de relations sexuelles ou pour le replacement d’un
embryon cryopréservé. Ce monitorage, réalisé sans ponc-
tion d’ovocyte, peut être effectué au cours d’un cycle spon-
tané, stimulé (inducteurs de l’ovulation) ou supplémenté
par des hormones exogènes. Les dosages hormonaux sont
également nécessaires en Fivete, c’est-à-dire au cours des
cycles stimulés selon différents protocoles associant l’uti-
lisation d’inducteurs de l’ovulation à un agoniste ou à un
antagoniste de la GnRH [26, 30] (tableau IV). Ils sont
couplés à une surveillance échographique régulière, qui
permet de visualiser le nombre et la taille des follicules
recrutés au cours de la stimulation.
Au cours de ces différents cycles, les trois hormones im-
portantes sont l’estradiol, la progestérone et la LH. Les
dosages de stéroïdes sont réalisés par des techniques direc-
tes et le plus souvent automatisées (systèmes fermés) car
les résultats doivent être exploitables dans la demi-journée
par les cliniciens pour moduler le traitement qui est admi-
nistré quotidiennement aux patientes. Il est donc impossi-
ble de mettre en place des techniques d’extraction et/ou de
chromatographie pour isoler les différents stéroïdes à do-
ser. Le choix des techniques de dosage doit cependant
tenir compte de l’ensemble des situations rencontrées au
cours des différents protocoles cliniques.
Tableau IV. Monitorage de l’ovulation : les différents types de cycles, les traitements et la surveillance hormonale
But Traitement ou stimulation Déclenchement
de l’ovulation
Surveillance hormonale
Cycle sans ponction d’ovocyte
Insémination intra-utérine Repérer ou déclencher le pic
de LH
Citrate de Clomiphène
a
FSH recombinante
b
FSH purifiée
c
HMG
d
Dans certains cas : hCG
exogène
g
(5 000 UI)
Estradiol #
LH #(ovulation spontanée)
ou normale (déclenchement)
Rapports sexuels
programmés
Repérer ou déclencher le pic
de LH
Citrate de Clomiphène
a
FSH recombinante
b
FSH purifiée
c
HMG
d
Dans certains cas : hCG
exogène
g
(5 000 UI)
Estradiol #
LH #(ovulation spontanée)
ou normale (déclenchement)
Replacement embryon
cryopréservé
Préparer la muqueuse utérine
au transfert
Estradiol exogène
e
Progestérone exogène
f
Estradiol #,
LH Normale ou #
Progestérone #
Cycle avec ponction d’ovocyte (Fivete) : désensibilisation + stimulation + déclenchement + FIV + transfert
Agoniste de la GnRH :
protocole long
Récupérer des ovocytes
matures
Agoniste de la GnRH
h
puis
FSH recombinante
b
hCG exogène
g
(5 000 ou 10 000 UI)
Estradiol #
Progestérone ne doit pas
augmenter
Agoniste de la GnRH :
protocole court
Récupérer des ovocytes
matures
Agoniste de la GnRH
h
et FSH
recombinante
b
hCG exogène
g
(5 000 UI) Estradiol #,LH&
Progestérone ne doit pas #
Antagoniste de la GnRH :
cycle spontané
Récupérer un ovocyte mature Antagoniste de la GnRH
i
hCG exogène
g
(5 000 UI) Estradiol #
LH et progestérone ne
doivent pas #
Antagoniste de la GnRH :
cycle stimulé
Récupérer des ovocytes
matures
FSH recombinante
b
puis
antagoniste de la GnRH
i
hCG exogène
g
(5 000 UI) Estradiol #
LH et progestérone ne
doivent pas #
a
Clomid
®
;
b
Gonal F
®
ou Puregon
®
;
c
Metrodin
®
ou Fertiline
®
;
d
Menopur
®
;
e
Progynova
®
ou Provames
®
;
f
Utrogestan
®
ou Estima
®
;
g
Gonadotrophine Chorionique Endo
®
ou
Profasi
®
;
h
Décapeptyl
®
ou Enanthone
®
ou Lucrin
®
ou Suprefact
®
;
i
Cetrotide
®
ou Orgalutran
®
.
Dosages hormonaux et AMP
Ann Biol Clin, vol. 61, n° 5, septembre-octobre 2003 537
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 24/05/2017.
 6
6
 7
7
 8
8
1
/
8
100%