Télécharger le PDF - LabEx MAbImprove

109
apbg Biologie Géologie n°1-2016
Les biomédicaments
1re partie : cadre général
Manon Broutin et Hervé Watier
Les biomédicaments bouleversent l’arsenal thérapeutique. De plus en plus
souvent produits par des cellules-usines génétiquement modifiées (OGM),
cultivées en milieu confiné, ils peuvent compenser l’absence de protéines
endogènes, ou agir à la manière de médicaments chimiques sur des cibles
pharmacologiques. Qu’est-ce qu’un biomédicament ? Qu’est-ce qu’un bio-
similaire ? Quels sont leurs usages ? Comment sont-ils produits ? C’était
le sujet passionnant de la conférence inaugurale du congrès international
d’Orléans-Tours du 13 juillet 2015. Cet article en deux parties abordera ces
différents points.
Qu’est-ce qu’un biomédicament ?
Lorsque cette question est posée au grand public, comme le montre le micro-
trottoir réalisé par le réseau de création et d’accompagnement pédagogiques (CA-
NOPE) de l’Académie d’Orléans-Tours(1), les réponses sont très variables. Beaucoup
ne connaissent pas ce mot, certains évoquent un médicament issu de l’agriculture
biologique, tandis que d’autres associent ce terme à de la médecine douce. Il n’en
est pourtant rien!
La définition légale du biomédicament, très ésotérique, est inscrite au Code de
la Santé Publique sous le terme synonyme de « médicament biologique »(2) (encadré
1). Biomédicament désigne plus simplement tout médicament dont la substance ac-
tive est une macromolécule thérapeutique produite par le vivant. Il est important
de prendre en compte tous les éléments de la définition, sans en omettre, et tout en
évitant les confusions évoquées ci-dessus et reprises dans l’encadré 2.
Médecine
u Mots clés : biomédicament, médicament biologique, biotechnologie, anticorps thérapeutique, biosimi-
laire
g Manon Broutin : étudiante en pharmacie à l’Université François-Rabelais de Tours ; stagiaire au
LabEx « MAbImprove »
Hervé Watier : professeur des Universités - Praticien Hospitalier en Immunologie, CHRU et Univer-
sité de Tours, UMR CNRS 7292 ; coordinateur du LabEx « MAbImprove » et du programme « ARD 2020
Biomédicaments » de la Région Centre-Val de Loire
(1) à (9) : renvois à la bibliographie

apbg Biologie Géologie n° 1-2016
110
Macromolécule se dit d’une molécule complexe se distinguant des petites molé-
cules chimiques par sa taille, jusqu’à 1000 fois supérieure. Souvent perçues par les
chimistes comme des monstres, les macromolécules sont cependant plus petites que
des nanoparticules !
Ni chimique, ni vivant, le biomédicament est en quelque sorte un intermédiaire
entre le médicament chimique et le médicament vivant (figure 1).
Encadré 1 : définition du biomédicament selon le Code de la Santé Publique
« On entend par médicament biologique, tout médicament dont la substance active
est produite à partir d’une source biologique ou en est extraite et dont la carac-
térisation et la détermination de la qualité nécessitent une combinaison d’essais
physiques, chimiques et biologiques ainsi que la connaissance de son procédé de
fabrication et de son contrôle. »
Article L5121-1 du Code de la santé publique
Texte extrait du site Légifrance en date du 04 janvier 2016
Encadré 2 : confusions à éviter
= Associer le terme biomédicament à un médicament issu de l’agriculture biolo-
gique à cause de son préfixe « bio ».
= Assimiler le biomédicament à de la médecine douce. Les biomédicaments sont
généralement des molécules très actives, potentiellement sources d’effets indési-
rables.
= Se restreindre au simple fait que le biomédicament est issu du vivant, puisque le
vivant est aussi pourvoyeur de nombreuses molécules chimiques (aspirine retrou-
vée dans la reine-des-prés, pénicilline issue de moisissures, morphine extraite du
pavot…), et de médicaments vivants (transfusions, greffes, vaccins constitués de
germes atténués…).

111
apbg Biologie Géologie n°1-2016
Les biomédicaments sont en très grande majorité de nature protéique, étant es-
sentiellement représentés par les vaccins non vivants, les anticorps thérapeutiques,
les enzymes, les hormones protéiques, ainsi que les facteurs de croissance. Outre ces
polymères d’acides aminés, dont certains comprennent également des sucres (gly-
coprotéines), les biomédicaments comprennent également les polymères complexes
de sucres (héparines) et potentiellement des polymères d’acides nucléiques. Comme
les protéines de notre alimentation, tous sont dégradés en fragments inactifs par les
1. Exemple pratique permettant de positionner le biomédicament par rapport au médi-
cament vivant et au médicament chimique, en référence à une situation physiologique,
celle du transport sanguin de l’oxygène.
Ce transport est assuré par le globule rouge, dont le diamètre est estimé à 7,4 µm. La pig-
mentation d’un globule rouge est due aux 200 à 300 millions de molécules d’hémoglobine qu’il
contient. Chaque molécule d’hémoglobine mesure 5 à 6 nm, et comporte quatre chaînes poly-
peptidiques identiques (sur le schéma, deux sont représentées en rouge, et deux autres en
bleu). A chacune de ces chaînes est associée une petite molécule d’hème de seulement 0,2 nm
(en vert), qui capte l’oxygène. Ces trois niveaux (globule rouge/cellule ; hémoglobine/protéine ;
hème/molécule chimique) permettent de positionner les trois catégories de médicaments :
- les globules rouges utilisés en transfusion sanguine sont un parfait exemple de thérapie
par injection de cellules vivantes (médicament vivant).
- l’hémoglobine humaine ne peut être injectée (trop toxique), mais une hémoglobine de
ver marin (Hémarina M-101) pourrait être employée comme transporteur d’oxygène. Cette
protéine développée par la société Hémarina à Morlaix pourrait donc un jour être un bio-
médicament.
- l’hème non plus ne peut être administré. En revanche, des patients peuvent être traités
par la vitamine B12, qui est une molécule chimique structurellement semblable à l’hème.
Essentielle au fonctionnement du système nerveux central et à la synthèse de globules
rouges, elle est administrée en cas de carence en vitamine B12.

apbg Biologie Géologie n° 1-2016
112
enzymes du tube digestif, rendant aujourd’hui obligatoire leur administration
par voie injectable.
Les premières générations de biomédicaments sont presque aussi vieilles que
l’humanité. En effet, l’opothérapie (grec opos, suc et therapeia, traitement), ou
l’administration à visée thérapeutique d’extraits d’organes d’origine animale, date
de la plus haute antiquité. De son côté, la sérothérapie s’est répandue dès la fin du
19e siècle (cf. partie II). Au milieu du 20e siècle, l’insuline était par exemple extraite
de pancréas de bœuf ou de porc. Mais depuis les années 1980, sa production est
assurée par des « cellules-usines » génétiquement modifiées, cultivées en milieu
confiné au sein de fermenteurs. L’industrie biopharmaceutique s’est délibérément
orientée vers le développement de nombreux biomédicaments recombinants (issus
d’ADN recombiné), mieux contrôlés, pour s’affranchir progressivement des biomé-
dicaments issus de sources humaines et animales.
Aujourd’hui, un peu moins de 200 biomédicaments sont commercialisés en
France(3). Cependant porteurs de perspectives prometteuses, ils révolutionnent de-
puis une dizaine d’années le secteur pharmaceutique. Poussés par des efforts de
recherche, plusieurs milliers de biomédicaments sont aujourd’hui en phase de déve-
loppement à travers le monde(4). Leur diversité et leur efficacité leur permet de lutter
contre toutes sortes de maladies de gravité et de fréquence variables, affectant des
patients de tous âges. Le temps de développement d’un biomédicament reste tout de
même de dix ans en moyenne.
Employés depuis longtemps, et aujourd’hui en plein essor, ils restent mécon-
nus du grand public. Comment l’expliquer ? Le terme de biomédicament n’est pas
très prisé des médecins ou des entreprises pharmaceutiques. Il n’est apparu que très
récemment, en 2004, lors d’une campagne de sensibilisation des pouvoirs publics
organisée par le syndicat des entreprises du médicament en France (Leem). Le Leem
s’alarmait alors du retard pris par la France dans le domaine de la bioproduction
pharmaceutique. Il fallut attendre 2007 pour que la définition du médicament biolo-
gique soit introduite dans le CSP (encadré 1)(2). En effet, la distinction de ce groupe
de médicaments ne fut nécessaire qu’en réponse à l’arrivée des biosimilaires sur le
marché.
Qu’est-ce qu’un biosimilaire ?
Avant de définir un biosimilaire, il est nécessaire de rappeler qu’un brevet per-
met de protéger une invention en accordant un monopole d’exploitation jusqu’à
l’expiration de celui-ci (classiquement 20 ans). Autrement dit, les biosimilaires ne
sont commercialisables qu’après l’extinction du brevet protégeant leur médicament
de référence. L’arrivée de la concurrence fait dès lors baisser les prix, et rend plus ac-
cessibles les produits dans le domaine pharmaceutique comme ailleurs. D’autre part,
tout médicament ne peut être commercialisé qu’après octroi d’une Autorisation de
Mise sur le Marché (AMM), à l’issue d’une approbation des autorités compétentes
(European Medicines Agency en Europe, Food and Drug Administration aux Etats-

113
apbg Biologie Géologie n°1-2016
Unis). Coûteuse pour les industriels, l’évaluation du nouveau médicament repose sur
des tests (essais cliniques) qui visent à prouver son efficacité, sa qualité, ainsi que
son innocuité envers le patient.
Les génériques sont les copies des médicaments chimiques : ils possèdent la
même composition quantitative et qualitative en principe actif. Pour les biomédica-
ments, les copies sont appelées biosimilaires et ne sont pas encadrées par les mêmes
textes législatifs. Ceci s’explique notamment par leurs procédés de fabrication et de
contrôle plus complexes qui ne permettent pas d’obtenir une stricte identité molécu-
laire, mais seulement de s’en rapprocher fortement : on parle de similitude des subs-
tances actives. Le législateur a donc exigé une évaluation des biosimilaires selon un
cahier des charges beaucoup plus strict que celui des génériques, incluant la réalisa-
tion d’essais cliniques. Il doit être prouvé que le biosimilaire sera aussi efficace et sûr
que son biomédicament de référence avant qu’une AMM ne lui soit accordée. Son
arrivée sur le marché a alors pour principal effet de faire baisser les coûts.
Quels sont les usages des biomédicaments ?
Une montée en puissance des biomédicaments, et plus particulièrement des
anticorps thérapeutiques (cf. partie II) est observée depuis une dizaine d’années.
En effet, l’arrivée de ces produits thérapeutiques a permis de soigner des maladies
jusqu’alors inguérissables. L’ensemble des biomédicaments cible principalement les
maladies infectieuses avec 30 %, les cancers et les maladies du sang avec 17 %, la
coagulation avec 14 %, la rhumatologie avec 7 %, la diabétologie avec 5 % et les
autres troubles hormonaux avec 4 % (source 2014(3)). Le développement de nou-
veaux biomédicaments est aujourd’hui très orienté vers le cancer et les maladies
inflammatoires, avec des préoccupations croissantes pour les infections résistantes
aux antibiotiques et les maladies orphelines.
Couvrant un arsenal thérapeutique très large, ils sont souvent classés en fonction
de leur activité thérapeutique.
Les biomédicaments substitutifs
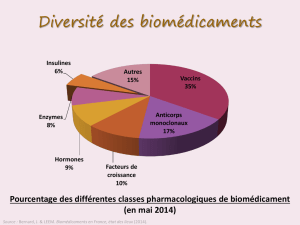
Ils concourent à la correction d’insuffisances ; leur classe comporte essentielle-
ment les vaccins, les interférons, les héparines, et les anticorps thérapeutiques. Ces
derniers sont en plein essor, et représentaient déjà 17 % des 173 biomédicaments
commercialisés en France en 2014(3) (cf.partie II). Les biomédicaments substitutifs
tels que l’insuline, l’hormone de croissance (GH), l’érythropoïétine (EPO), le fac-
teur VIII de la coagulation, et l’α-glucosidase, sont majoritairement des traitements
chroniques, pouvant être administrés tout au long de la vie des patients.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%