Hormone de croissance et effets métaboliques

Synthèse
Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 5, septembre-octobre 2001
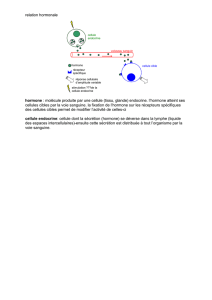
hormone de croissance (GH-growth
hormone) a des effets complexes sur les
métabolismes glucidique (hormone hypergly-
cémiante), protidique (hormone anabolisante
par excellence), lipidique (hormone lipoly-
tique) et sur le métabolisme osseux.
Si ce dernier a focalisé l’attention des
pédiatres jusqu’à ces dernières années, les
premiers ont été plus systématiquement étu-
diés par les médecins d’adultes dans le déficit
en GH (GHD) ou l’acromégalie, nous appor-
tant l’essentiel des données sur les effets
métaboliques de la GH et leurs intérêts.
Des études prospectives chez l’enfant devront
être menées, mais déjà quelques travaux
rétrospectifs donnent des orientations.
Grâce aux études publiées depuis 1989 (1) sur
les adultes atteints de GHD, il a pu être mon-
tré que les patients souffrant d’un déficit sévè-
re présentent :
●
une intolérance glucidique avec hyperinsu-
linisme,
●
une composition corporelle anormale, avec
augmentation de la masse grasse, en particu-
lier du tissu adipeux viscéral, et une diminu-
tion de la masse maigre,
●
des anomalies du profil lipidique :
– augmentation du cholestérol total (CT), du
LDL-cholestérol et de l’apolipoprotéine B
(apo B)
– augmentation inconstante des triglycérides
(TG)
– diminution du HDL-cholestérol et donc une
augmentation du rapport athérogène LDL/HDL,
●
une HTA avec complications cardiovas-
culaires.
L’ensemble de ces anomalies compose ce que
l’on appelle le « syndrome métabolique » ou
«syndrome X ».
●
une réduction de la densité minérale osseu-
se (DMO) avec augmentation du risque frac-
turaire,
●
une baisse de la qualité de vie
Le traitement substitutif par GH corrige la
plupart de ces anomalies (2).
GH et métabolisme glucidique
chez l’enfant et l’adolescent
Deux travaux récents méritent attention :
✓
Un travail de l’équipe de Lyon (P. Chatelain)
(3).
Deux populations réputées à haut risque
d’in-
tolérance glucidique (
retards de croissan
ce
intra-utérin – RCIU – et syndrome de Turner)
ont été étudiées avant et après traitement par
GH et comparées à une population d’enfants
obèses.
Avant traitement, les enfants des groupes
Turner et RCIU ont des rapports insuline/gly-
cémie similaires au cours de l’hyperglycémie
provoquée par voie orale (HGPO). Par
ailleurs, ces rapports sont inférieurs à ceux
des obèses.
Après traitement, ces rapports s’élèvent dans
les deux groupes Turner et RCIU, plus nette-
ment dans le groupe Turner, mais restent
cependant inférieurs à ceux des enfants obèses.
✓
Une étude rétrospective publiée récemment
(4),a tenté d’apprécier l’émergence du
diabète
sur une population de 23 333 patients (enfants
et adolescents) traités par GH et issus de
l’étude KIGS (Kabi International Growth
Study).
Cette population représentait 33 pays diffé-
rents et 52 375 années-traitement (la moitié
des enfants ayant reçu plus de 3 ans de GH).
Quarante-trois enfants ont présenté des anoma-
lies confirmées du métabolisme glucidique :
11 diabètes de type 1, 18 diabètes de type 2 et
14 intolérances au glucose.
Il n’a pas été observé d’augmentation d’inci-
dence du diabète de type 1 chez l’enfant ou
l’adolescent traités par GH par rapport à l’in-
cidence attendue dans cette tranche d’âge
(5, 6).
En revanche, il est retrouvé une incidence du
diabète de type 2 multipliée par 6 par rapport
à deux groupes de populations américaine et
japonaise, de même âge (4).
Tous les enfants et adolescents ont conservé
leurs anomalies glucidiques après l’arrêt de
GH, excluant ainsi a priori un effet inducteur
direct de GH.
Certes, il existe ces dernières années une aug-
mentation substantielle de cette incidence
dans la population générale, mais elle ne peut
expliquer une telle différence. Le traitement
par GH a peut-être révélé ou avancé l’appari-
Hormone de croissance et effets métaboliques
I. Oliver*, M. Tauber*
223
L’
* Pédiatre endocrinologue, CHU Purpan,
Toulouse.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 5, septembre-octobre 2001
tion d’un désordre glucidique qui serait de
toute façon apparu à l’âge adulte.
La GH, comme l’obésité d’ailleurs, en modi-
fiant la sensibilité à l’insuline, pourrait préci-
piter l’apparition d’un diabète de type 2, ou
d’une intolérance au glucose, chez des
patients prédisposés.
Ces résultats inquiétants doivent mobiliser les
pédiatres endocrinologues afin de réaliser des
études prospectives sur la tolérance au glucose
dans les traitements prolongés par GH ; mais
aussi les inciter à une plus grande prudence et
rigueur dans la mise en route et le suivi des
traitements GH :
●
en recherchant les facteurs de risque.
– familiaux (dans l’étude rétrospective rap-
portée ci-dessus, 50% des enfants avaient une
histoire familiale de diabète !),
– pathologies associées prédisposantes :
Turner, RCIU, Prader-Willi (7, 8).
●
En surveillant avant et pendant le traite-
ment :
– glycémie à jeun, Hb A1C.
– HGPO pour les populations à risques.
GH et métabolisme lipidique
chez l’enfant et l’adolescent
Composition corporelle
Les données actuellement disponibles ne
concernent pratiquement que les adolescents
GHD en fin de traitement et dont les résultats,
en rapport avec la composition corporelle,
sont assez superposables à ceux des adultes
GHD traités et non traités.
Dans le travail de Göteborg (9),il est intéres-
sant de noter qu’à l’arrêt de GH, les adoles-
cents déficitaires ont une masse grasse anor-
male par rapport aux non déficitaires, ce qui
va s’accentuer au cours des années sans trai-
tement, alors que la GH diminue la masse
grasse et augmente la masse maigre.
Or, au cours de la période de traitement, ces
enfants ont des taux d’IGF1 au-dessus de la
normale, ce qui laisse supposer que, IGF1 et
GH ayant des effets opposés, on augmente
peut-être la masse grasse de ces adolescents
en les surdosant.
Profil lipidique
Il a été très peu étudié chez l’enfant GHD qui
ne semble pas présenter de perturbations
franches comme l’adulte.
Le CT avant traitement n’est pas augmenté de
façon significative (baisse du HDL-cholesté-
rol ?) ; TG et LDL-cholestérol sont normaux
(10).
Sous traitement, on observe une diminution
précoce et persistante du taux de CT avec
augmentation du rapport apo A1/ apo B.
Mécanismes d’action de GH sur
le profil lipidique
L’observation clinique (11, 12) nous a appris
que GH est plus active sur les anomalies du
profil lipidique que l’IGF1.
✓
Au niveau de l’adipocyte, la GH stimule la
libération des acides gras libres (AGL) par
effet direct particulièrement sur le tissu sous-
cutané. Ces AGL peuvent alors être oxydés en
périphérie ou recaptés par le foie et être rées-
térifiés en TG.
La GH augmente la sécrétion de VLDL,
parallèlement à la synthèse de l’apo B 48, ce
qui augmente la clairance des VLDL : une
fraction de celles-ci est convertie en LDL,
entraînant une diminution de la synthèse des
LDL.
La GH joue aussi un rôle primordial dans la
différenciation adipocytaire.
✓
Au niveau hépatique, la GH régule le récep-
teur hépatique des LDL et augmente leur
catabolisme. Elle agit sur les enzymes respon-
sables du transfert des lipides. Elle sensibilise
à l’action d’autres facteurs (œstrogènes) (11).
Si la GH a un effet direct sur le tissu adipeux,
il a été récemment montré (13) qu’une petite
séquence polypeptidique de synthèse, homo-
logue de la partie C terminale de la molécule
de GH, AOD-9401, administrable par voie
orale, possède les mêmes particularités acti-
vatrices lipolytique et frénatrice de la lipoge-
nèse.
La GH a donc différents points d’impact au
niveau du métabolisme lipidique, expliquant
peut-être les grandes variations cliniques
observées, difficiles à interpréter.
Cependant, sur le plan pratique, on retiendra :
– que la femme est moins sensible à la GH
que l’homme et que son profil lipidique sous
GH est plus perturbé (14) ;
– que les anomalies se corrigent d’autant
mieux qu’elles étaient importantes avant trai-
tement et que le déficit en GH est intense (11) ;
– que le taux de CT est plus bas chez les
adultes dont le déficit a débuté dans l’enfance
par rapport à ceux qui se sont révélés plus tar-
divement carencés (10, 15).
Si l’action de la GH sur le métabolisme lipi-
dique est complexe et mal connu, il est impor-
tant de suivre les effets du traitement sur ce
métabolisme afin de savoir si on diminue
réellement l’athérosclérose et le risque de
surmorbidité et de surmortalité cardiovascu-
laires du patient déficitaire traité.
GH et métabolisme osseux
chez l’enfant
L’effet principal de la GH est d’induire et de
maintenir la croissance staturale directement
ou indirectement par l’IGF1. L’hormone de
croissance stimule la croissance longitudinale
osseuse pendant l’enfance, jusqu’à la soudure
des épiphyses, mais elle agit aussi sur le
métabolisme osseux et le maintien de la
masse osseuse pendant toute la vie (16).
Croissance linéaire
Chez l’enfant GHD, les marqueurs de la for-
mation osseuse comme l’ostéocalcine, les
phosphatases alcalines et le propeptide ami-
noterminal du procollagène de type III
(PIIINP) sont réduits.
Avec le traitement par GH, ces taux augmen-
224
Synthèse

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 5, septembre-octobre 2001
tent progressivement et parallèlement à la
vitesse de croissance (2, 17).
Ces paramètres pourraient être d’utiles
marqueurs prédictifs de la vitesse de crois-
sance lors des traitements par GH.
Masse osseuse
On observe chez l’enfant GHD une réduction
significative de la masse osseuse. On connaît
le rôle primordial de la GH dans la réalisation
du pic de masse osseuse. Le déficit en GH est
donc directement impliqué dans le dévelop-
pement de l’ostéopénie chez les enfants GHD
durant la période pubertaire par réduction de
la formation osseuse et retard à la réalisation
de ce pic (2, 17).
Le traitement par GH permet une récupéra-
tion significative, mais non totale, de la den-
sité osseuse et prévient l’aggravation de l’os-
téopénie ultérieure. La densité osseuse, en
effet, augmente graduellement après 12 à
24 mois de traitement par GH et n’atteint des
valeurs proches de la normale chez l’enfant
qu’après 56 à 58 mois de traitement !
Chez les enfants GHD, le suivi de la masse
osseuse est conseillé pendant le traitement
par GH, particulièrement durant la période
pubertaire, et même après la fin de la crois-
sance linéaire.
Le traitement par GH devrait pouvoir se pour-
suivre au-delà de la soudure des épiphyses
afin d’obtenir un pic de masse osseuse appro-
prié chez les jeunes qui conservent un déficit
somatotrope alors qu’ils ont atteint leur taille
finale.
Conclusion
Les résultats obtenus ces dernières années
grâce aux études initiées chez les adultes
GHD confirment que les déficits hypophy-
saires ou les GHD débutant à l’âge pédia-
trique ont des conséquences graves à long
terme sur la santé des patients compte tenu
des effets métaboliques de la GH.
L’obtention d’une taille finale satisfaisante
pour les jeunes patients GHD ne doit pas être
la finalité de nos traitements par GH : le dia-
gnostic des déficits complets en fin de crois-
sance doit être posé sans retard afin d’offrir
une prise en charge thérapeutique jusqu’à pleine
maturité et un relais de bonne qualité avec
l’équipe médicale adulte.
Références
1. De Boer H, Blok GJ, Van der Veen EA.
Clinical aspects of growth hormone deficiency
in adults. Endocrine Rev 1995 ; 16 : 63-86.
2. Carrol PV, Christ ER and the members of
growth hormone research society scientific
Committee (Bengtsson BA, Carlsson L,
Christiansen JJ, Clemmons D, Hintz R, Ho K,
Laron Z, Sizonenko P, Sönksen PH, Tanaka T,
Thorner M). Growth hormone deficiency in
adulthood and the effects of growth hormone
replacement : a review. J Clin Endocrinol
Metab 1998 ; 83 : 382-95.
3. Communication Orale JTA 2000.
4. Cutfield W, Wilton P, Bennmarker H et al.
Incidence of diabetes mellitus and impaired glu-
cose tolerance in children and adolescents
receiving growth-hormone treatment. Lancet
2000 ; 355 : 610-3.
5. Kitagawa T, Owada M, Urakami T, Tajima N.
Epidemiology of type 1 (insulin-dependent)
and type 2 (non-insulin-dependent) diabetes
mellitus in Japanese children. Diabetes Res
Clin Pract 1994 ; 24 (suppl.) : S7-13.
6. Pinhas-Hamiel O, Dolan LM, Daniels SR et
al. Increased incidence of non-insulin-
dependent diabetes mellitus among adoles-
cents. J Pediatr 1996 ; 128 : 608-15.
7. Hofman PL, Cutfield WS, Robinson EM et al.
Insulin resistance in short children with intrau-
terine growth retardation. J Clin Endocrinol
Metab 1997 ; 82 : 402-6.
8. Caprio S, Boulware D, Tamborlane V.
Growth hormone and insulin interactions.
Horm Res 1992 ; 38 (suppl. 2) : 47-9.
9. Johannsson G, Albertsson-Wikland K.
Discontinuation of growth hormone (GH) treat-
ment : metabolic effects in GH-deficient and
GH-sufficient adolescent patients compared
with control subjects. J Clin Endocrinol 1999 ;
84 : 4516-24.
10. Van Der Lely AJ, Lamberts SWJ. Childhood
and adult onset growth hormone deficiency :
similarities and differences in GH replacement
in adults. In the first 5 years of KIMS.
Bengt-Ake Bengtsson and John P. Monson (Ed),
2000 ; 151-5.
11.Angelin B, Rudling M. Growth hormone and
hepatic lipoprotein metabolism. Cur Op Lipid
1994 ; 5 : 160-5.
12. Mauras N, O’Brien KO, Welch S et al.
Insulin-like growth factor I and growth hormo-
ne (GH) treatment in GH-deficient humans : dif-
ferential effects on protein, glucose, lipid, and
calcium metabolism. J Clin Endocrinol Metab
2000 ; 85 : 1686-94.
13. Heffernan M, Jiang W, Thorburn A, Ng F.
Effects of oral administration of a synthetic
fragment of human growth hormone on lipid
metabolism. Am J Physiol Endocrinol Metab
2000 ; 279 : E501-E507.
14. Bengtssonn BA, Johannson G, Shalet SM
et al. Therapeutic controversy of growth hor-
mone deficiency in adults. J Clin Endocrinol
Metab 2000 ; 86 : 933-42.
15.Attanasio AF, Lamberts SW, Matranga AM
et al. Adult growth hormone deficiency
patients demonstrate heterogeneity between
childhood onset and adult onset before and
during human GH treatment. Adult growth
hormone deficient study group. J Clin
Endocrinol Metab 1997 ; 82 : 82-8.
16. Ohlsson C, Bengtsson BA, Isaksson OGP
et al. Growth hormone and bone. Endocrine
Rev 1998 ; 19 : 55-79.
17. Saggese G, Baroncelli GI, Bertelloni S,
Barsanti S. The effect of long-term treat-
ment with growth hormone (GH) on bone
mineral density in children with GH defi-
ciency. Role of GH in the attainment of peak
bone mass. J Clin Endocrinol Metab 1996 ;
81 : 3077-83.
225
Synthèse
1
/
3
100%