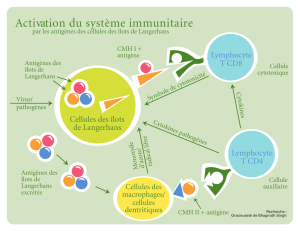
La cellule de Langerhans - iPubli

La cellule de Langerhans
D




 6
6
 7
7
 8
8
 9
9
1
/
9
100%