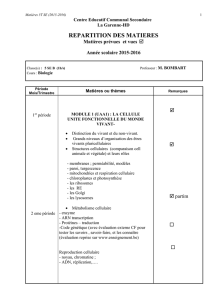
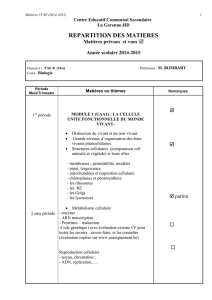
Mécanismes de la cancérogenèse

Mécanismes de la cancérogenèse
Dr. Jocelyn CERALINE
UdS/Faculté de Médecine/EA4438
Laboratoire Signalisation et Cancer de la prostate
Service d’Hématologie et d’Oncologie – HUS

La genèse d’une cellule cancéreuse
Question récurrente
Quels sont les évènements qui au niveau moléculaire,
cellulaire et tissulaire conduisent à la cancérogenèse ???

La genèse d’une cellule cancéreuse
Le dogme de la mutation somatique
Le rôle du stroma
Liens avec l’embryogenèse et la différenciation cellulaire
Les cellules souches tumorales

Le dogme de la mutation somatique
Hugo de Vries (1901) : Concept de mutation pour expliquer la sélection
naturelle.
Theodore Boveri/David Hansemann (1914) : Origine génétique des cancers
Notions d’agents mutagènes ou carcinogènes (1914-1940s):
Démonstrations que des agents extérieurs (chimiques ou physiques)
pouvaient conduire au cancer.
Agents génotoxiques => lésions de l’ADN => Mutations => Cancer
Le cancer serait donc une maladie de l’ADN.
En touchant des gènes clés, les mutations affectent des voies de
signalisation impliquées dans les mécanismes homéostatiques qui
gouvernent normalement la prolifération cellulaire.

La notion de «!mutation!» englobe différentes altérations génétiques :
- les mutations ponctuelles
- les courtes délétions ou insertions
- les pertes ou gains chromosomiques
- les translocations
- les insertion de séquences nucléotidiques virales.
Ces altérations génétiques peuvent être spontanées ou héréditaires.
Elles sont causées par un agent viral, ou résultent d’agressions génotoxiques
physiques ou chimiques.
Le dogme de la mutation somatique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
1
/
54
100%