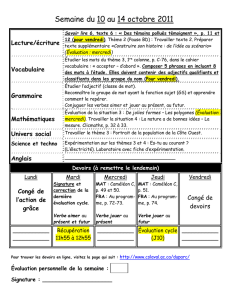
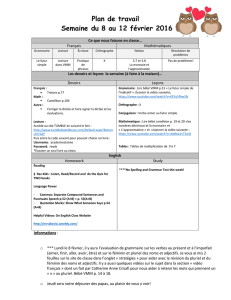
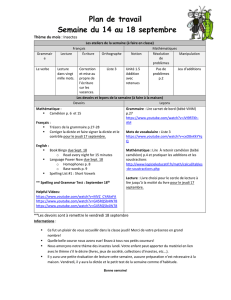
CAMÉLÉONS : BIOLOGIE, ÉLEVAGE ET PRINCIPALES

ÉCOLE NATIONALE VÉTÉRINAIRE D’ALFORT
ANNÉE 2006
CAMÉLÉONS : BIOLOGIE, ÉLEVAGE
ET PRINCIPALES AFFECTIONS
THÈSE
pour le
DOCTORAT VÉTÉRINAIRE
présentée et soutenue publiquement
devant
LA FACULTÉ DE MÉDECINE DE CRETEIL
le
par
Fany JUNIUS-BOURDAIN
Née le 9 novembre 1973 à Sartrouville (Yvelines)
JURY
Président : M.
Professeur à la Faculté de Médecine de Créteil
Membres
Directeur : M. Chermette
Professeur à l’École nationale vétérinaire d’Alfort
Assesseur : M. Courreau
Professeur à l’École nationale vétérinaire d’Alfort

LISTE DES MEMBRES DU CORPS ENSEIGNANT
Directeur : M. le Professeur COTARD Jean-Pierre
Directeurs honoraires : MM. les Professeurs MORAILLON Robert, PARODI André-Laurent, PILET Charles
Professeurs honoraires: MM. BUSSIERAS Jean, LE BARS Henri, MILHAUD Guy, ROZIER Jacques
DEPARTEMENT DES SCIENCES BIOLOGIQUES ET PHARMACEUTIQUES (DSBP)
Chef du département : M. BOULOUIS Henri-Jean, Professeur - Adjoint : M. DEGUEURCE Christophe, Professeur
-UNITE D’ANATOMIE DES ANIMAUX DOMESTIQUES
Mme CREVIER-DENOIX Nathalie, Professeur
M. DEGUEURCE Christophe, Professeur*
Mlle ROBERT Céline, Maître de conférences
M. CHATEAU Henri, Maître de conférences
-UNITE DE PATHOLOGIE GENERALE , MICROBIOLOGIE,
IMMUNOLOGIE
Mme QUINTIN-COLONNA Françoise, Professeur*
M. BOULOUIS Henri-Jean, Professeur
-UNITE DE PHYSIOLOGIE ET THERAPEUTIQUE
M. BRUGERE Henri, Professeur
Mme COMBRISSON Hélène, Professeur*
M. TIRET Laurent, Maître de conférences
-UNITE DE PHARMACIE ET TOXICOLOGIE
Mme ENRIQUEZ Brigitte, Professeur *
M. TISSIER Renaud, Maître de conférences
M. PERROT Sébastien, Maître de conférences
-DISCIPLINE : BIOCHIMIE
M. MICHAUX Jean-Michel, Maître de conférences
- UNITE D’HISTOLOGIE , ANATOMIE PATHOLOGIQUE
M. CRESPEAU François, Professeur
M. FONTAINE Jean-Jacques, Professeur *
Mme BERNEX Florence, Maître de conférences
Mme CORDONNIER-LEFORT Nathalie, Maître de conférences
- UNITE DE VIROLOGIE
M. ELOIT Marc, Professeur *
Mme LE PODER Sophie, Maître de conférences
-DISCIPLINE : PHYSIQUE ET CHIMIE BIOLOGIQUES ET
MEDICALES
M. MOUTHON Gilbert, Professeur
-DISCIPLINE : GENETIQUE MEDICALE ET CLINIQUE
Melle ABITBOL Marie, Maître de conférences
-DISCIPLINE : ETHOLOGIE
M. DEPUTTE Bertrand, Professeur
-DISCIPLINE : ANGLAIS
Mme CONAN Muriel, Ingénieur Professeur agrégé certifié
DEPARTEMENT D’ELEVAGE ET DE PATHOLOGIE DES EQUIDES ET DES CARNIVORES (DEPEC)
Chef du département : M. FAYOLLE Pascal, Professeur - Adjoint : M. POUCHELON Jean-Louis , Professeur
- UNITE DE MEDECINE
M. POUCHELON Jean-Louis, Professeur*
Mme CHETBOUL Valérie, Professeur
M. BLOT Stéphane, Maître de conférences
M. ROSENBERG Charles, Maître de conférences
Mme MAUREY Christelle, Maître de conférences contractuel
- UNITE DE CLINIQUE EQUINE
M. DENOIX Jean-Marie, Professeur
M. AUDIGIE Fabrice, Maître de conférences*
Mme GIRAUDET Aude, Professeur contractuel
Mme MESPOULHES-RIVIERE Céline, Maître de conférences
contractuel
Melle VIREVIALLE Hameline, Maître de conférences contractuel
-UNITE DE REPRODUCTION ANIMALE
Mme CHASTANT-MAILLARD Sylvie, Maître de conférences*
(rattachée au DPASP)
M. NUDELMANN Nicolas, Maître de conférences
M. FONTBONNE Alain, Maître de conférences
M. REMY Dominique, Maître de conférences (rattaché au DPASP)
M. DESBOIS Christophe, Maître de conférences
Melle CONSTANT Fabienne, AERC (rattachée au DPASP)
Melle LEDOUX Dorothée, Maître de conférences Contractuel
(rattachée au DPASP)
- UNITE DE PATHOLOGIE CHIRURGICALE
M. FAYOLLE Pascal, Professeur *
M. MAILHAC Jean-Marie, Maître de conférences
M. MOISSONNIER Pierre, Professeur
Mme VIATEAU-DUVAL Véronique, Maître de conférences
Mlle RAVARY Bérangère, Maître de conférences (rattachée au DPASP)
M. ZILBERSTEIN Luca, Maître de conférences contractuel
M. HIDALGO Antoine, Maître de conférences contractuel
- UNITE DE RADIOLOGIE
Mme BEGON Dominique, Professeur*
Mme STAMBOULI Fouzia, Maître de conférences contractuel
-UNITE D’OPHTALMOLOGIE
M. CLERC Bernard, Professeur*
Melle CHAHORY Sabine, Maître de conférences contractuel
- UNITE DE PARASITOLOGIE ET MALADIES PARASITAIRES
M. CHERMETTE René, Professeur
M. POLACK Bruno, Maître de conférences*
M. GUILLOT Jacques, Professeur
Mme MARIGNAC Geneviève, Maître de conférences contractuel
-UNITE DE NUTRITION-ALIMENTATION
M. PARAGON Bernard, Professeur *
M. GRANDJEAN Dominique, Professeur
Mme BLANCHARD Géraldine, Professeur contractuel
DEPARTEMENT DES PRODUCTIONS ANIMALES ET DE LA SANTE PUBLIQUE (DPASP)
Chef du département : M.MAILLARD Renaud, Professeur - Adjoint : Mme DUFOUR Barbara, Maître de conférences
-UNITE DES MALADIES CONTAGIEUSES
M. BENET Jean-Jacques, Professeur*
M. TOMA Bernard, Professeur
Mme HADDAD/ H0ANG-XUAN Nadia, Maître de conférences
Mme DUFOUR Barbara, Maître de conférences
-UNITE D’HYGIENE ET INDUSTRIE DES ALIMENTS
D’ORIGINE ANIMALE
M. BOLNOT François, Maître de conférences *
M. CARLIER Vincent, Professeur
M. CERF Olivier, Professeur
Mme COLMIN Catherine, Maître de conférences
M. AUGUSTIN Jean-Christophe, Maître de conférences
- DISCIPLINE : BIOSTATISTIQUES
M. SANAA Moez, Maître de conférences
- UNITE DE ZOOTECHNIE, ECONOMIE RURALE
M. COURREAU Jean-François, Professeur
M. BOSSE Philippe, Professeur
Mme GRIMARD-BALLIF Bénédicte, Professeur
Mme LEROY Isabelle, Maître de conférences
M. ARNE Pascal, Maître de conférences
M. PONTER Andrew, Maître de conférences*
- UNITE DE PATHOLOGIE MEDICALE DU BETAIL ET DES
ANIMAUX DE BASSE-COUR
M. MILLEMANN Yves, Maître de conférences*
Mme BRUGERE-PICOUX Jeanne, Professeur
M. MAILLARD Renaud, Maître de conférences
M. ADJOU Karim, Maître de conférences
Mme CALAGUE, Professeur d’Education Physique * Responsable de l’Unité AERC : Assistant d’Enseignement et de Recherche
Contractuel

R
R
RE
E
EM
M
ME
E
ER
R
RC
C
CI
I
IE
E
EM
M
ME
E
EN
N
NT
T
TS
S
S
Je souhaite remercier vivement le Dr Lionel SCHILLIGER pour
m’avoir donné accès à son immense bibliothèque personnelle et pour
avoir accepté de me transmettre un peu de son savoir en m’accueillant
en stage auprès de lui.
Je remercie le Dr Christophe BULLIOT pour avoir si bien joué au
paparazzi avec les caméléons de sa clientèle.
Je tiens également à remercier chaleureusement le Dr Nelly DULIEU
pour avoir tant patienté et pour toujours tolérer dans son cabinet toutes
ces bêtes bizarres à poils, à plumes et à écailles…
Enfin je voudrais adresser un dernier remerciement aux membres du
Jury et aux Professeurs CHERMETTE et COURREAU qui ont si
gentiment pris la peine et le temps de relire et corriger ce travail.
Merci à vous tous.

- 1 -
T
T
TA
A
AB
B
BL
L
LE
E
E
D
D
DE
E
ES
S
S
M
M
MA
A
AT
T
TI
I
IÈ
È
ÈR
R
RE
E
ES
S
S
T
T
TA
A
AB
B
BL
L
LE
E
E
D
D
DE
E
ES
S
S
I
I
IL
L
LL
L
LU
U
US
S
ST
T
TR
R
RA
A
AT
T
TI
I
IO
O
ON
N
NS
S
S p.9
I
I
IN
N
NT
T
TR
R
RO
O
OD
D
DU
U
UC
C
CT
T
TI
I
IO
O
ON
N
N
p.11
I. P
P
PR
R
RÉ
É
ÉS
S
SE
E
EN
N
NT
T
TA
A
AT
T
TI
I
IO
O
ON
N
N
G
G
GÉ
É
ÉN
N
NÉ
É
ÉR
R
RA
A
AL
L
LE
E
E p.11
1. CLASSIFICATION p.12
2. ORIGINE p.17
3. ÉVOLUTION p.17
4. RÉPARTITION GÉOGRAPHIQUE p.18
5. BIOTOPES p.20
6. ETUDE SPÉCIFIQUE p.20
6.1. SOUS-FAMILLE DES BROOKÉSIINÉS p.20
6.1.1. Genre Brookesia p.20
6.1.2. Genre Rampholeon p.21
6.2. SOUS-FAMILLE DES CAMÉLÉONINÉS p.21
6.2.1. Genre Bradypodion p.21
6.2.2. Genre Calumna p.21
6.2.3. Genre Chamaeleo p.21
6.2.4. Genre Furcifer p.21
I
I
II
I
I.
.
.
B
B
BI
I
IO
O
OL
L
LO
O
OG
G
GI
I
IE
E
E
p.22
1. PARTICULARITÉS MORPHOLOGIQUES p.22
1.1. TAILLE p.22
1.2. TÊTE p.22
1.3. CORPS p.23
1.4. MEMBRES p.24
1.5. QUEUE p.26
2. PARTICULARITÉS ANATOMIQUES p.26

- 2 -
2.1. APPAREIL CARDIO-RESPIRATOIRE p.26
2.1.1. Cœur et vaisseaux sanguins p.26
2.1.2. Sang p.27
2.1.3. Poumons p.27
2.2. APPAREIL CUTANÉ p.28
2.2.1. Écailles p.28
2.2.2. Peau p.28
2.2.3. Mue p.29
2.3. APPAREIL DIGESTIF p.29
2.3.1. Dents p.29
2.3.2. Langue p.30
2.3.3. Estomac p.31
2.3.4. Intestins p.31
2.3.5. Organes annexes p.31
2.4. APPAREIL MUSCULO-SQUELETTIQUE p.31
2.5. APPAREIL SENSORIEL p.32
2.5.1. Système nerveux p.32
2.5.2. Organes visuels p.32
2.5.3. Organes auditifs p.33
2.5.4. Organes olfactif et gustatif p.34
2.5.5. Œil pariétal ou troisième œil p.34
2.6. APPAREIL URO-GÉNITAL p.35
3. PARTICULARITÉS PHYSIOLOGIQUES p.35
3.1. THERMORÉGULATION p.35
3.2. CHANGEMENT DE COULEUR p.36
3.2.1. Mécanisme de la coloration p.36
3.2.2. Facteurs intervenant dans la coloration p.38
3.2.2.1. Facteurs extérieurs au caméléon p.38
3.2.2.1.1. Température p.38
3.2.2.1.2. Intensité de la lumière p.38
3.2.2.1.3. Moment de la journée p.38
3.2.2.1.4. Saison de l’année p.38
3.2.2.2. Facteurs propres au caméléon p.38
3.2.2.2.1. Facteurs passifs p.38
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
1
/
189
100%