Developpement d`une Thérapie optogénétique dans le cadre des

DEVELOPPEMENT D’UNE THERAPIE
OPTOGENETIQUE DANS LE CADRE
DES RETINITES PIGMENTAIRES
Encadrement : Laurence Nieto et Rémy Poupot
Camille GRASMUCK
Mélissa HANIQUE
Victor TRAMON
Yannick VIEU


Remerciements
Nous souhaitons remercier tout d’abord Laurence Nieto pour l’aide précieuse qu’elle nous a
apportée, pour sa bienveillance en toutes circonstances. Nous la remercions également pour la
confiance qu’elle nous a témoignée tout au long du projet malgré l’exotisme de notre sujet.
Nous remercions Rémy Poupot pour son attention et sa sympathie.
Enfin, nous remercions tous les acteurs de notre année de master, pour cet apprentissage
agréablement intensif.
« Comment un parachutiste aveugle sait-il qu'il va toucher le sol ?
Quand il y a du mou dans la laisse du chien. »


Résumé
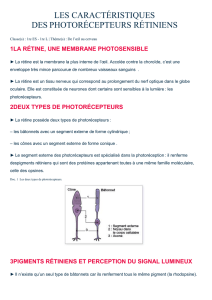
La rétinite pigmentaire regroupe un ensemble de maladies progressives et génétiques
qui amène à une perte de la vision incurable et touchent deux millions de personnes à travers la
monde. Cette pathologie induit une dégénérescence précoce des photorécepteurs de la rétine et
de l'épithélium pigmentaire. Les cônes sont les cellules photoréceptrices permettant la vision
diurne. En cas de rétinite pigmentaire, ils sont très vite dégénérés. La dégénérescence
commence par les segments externes. Cette structure particulière est responsable de la
transduction du signal lumineux en signal chimique.
Dans le but de progresser dans la thérapie des rétinites pigmentaires, Busskamp et ses
collaborateurs ont montré que l’expression du cluster de microARNs 183/96/182 est suffisant
pour le maintien des segments externes lorsque la machinerie de maturation de l’ensemble des
microARNs est absente. Cependant, le modèle étudié ici n’est pas représentatif d’une
pathologie existante chez l’Homme. Ainsi, le projet c’est tourné vers une autre perspective
appelée la thérapie optogénétique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%