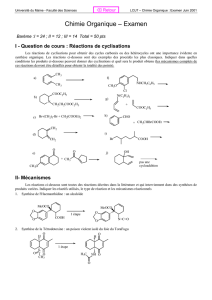
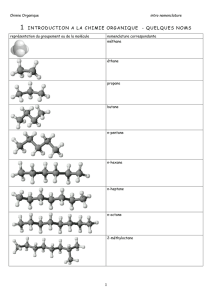
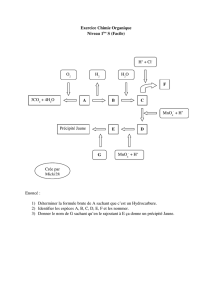
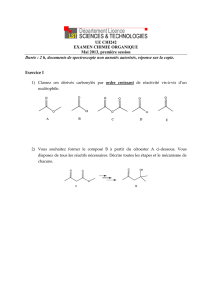
Chimie organique I- Chimie organique générale I

Chimie organique
I- Chimie organique générale
I- Introduction
La chimie organique est une vaste discipline recoupant des secteurs aussi varié que la Biologie, la
médecine, et la pharmacologie, la technologie des polymères, l’agriculture ou l’ingénierie du pétrole)
Le bute de ce module est d’acquérir des connaissances pour en être utiliser en chimie organique ou
appliqué a d’autre domaine tels que la médecine et la pharmacologie
II- Généralités :
Qu’est ce que la chimie organique ?
Initialement la chimie organique était la chimie des composés issus des organismes vivants (règne
animal ou végétal) tandis que la chimie minérale étudiait les composés issus du monde minéral
(composés minéraux)
Cette distinction n’est plus valable lorsque le chimiste WOHLER en 1828 a réussi à faire la synthèse
de l’urée de formule NH2 - C(O) – NH2 composé organique a partir d’une substance d’ammonium de
formule , CNO- par simple chauffage selon la réaction
, CNO H2O – C – NH2
O
= chauffage
Urée : déchets du métabolisme azoté, éliminé par les urines
La chimie organique concerne l’étude de la structure et de la réactivité des composés du carbone
rencontrés dans les organismes
La définition la plus adaptée actuellement de la chimie des substances carbonées
Chimie organique = Chimie du carbone
III- Présentation des molécules organiques
1) Formule brute
Le carbone est l’élément le plus fréquent ou le plus important, H, O, N
Les halogènes X : Cl, Br, I, F.
Les non-métaux : S, P.

On peut trouver aussi les métaux les alcalin, les alcalinoterreux tels que : Li, Na, Mg, Ca est quelque
fois les métaux de transition : Zn, Pb
En dehors de carbone et l’hydrogène tous les autres éléments sont des Hétéroatomes
CxHyOzNt
x, y, z, t des nombre entiers déterminée par l’analyse
La nature et le nombre d’atomes constituants la molécule, la masse molaire
(Pas beaucoup d’intérêt en C.O)
Ainsi deux composés peuvent avoir une même formule brute avec des fonctions différentes : ce sont
les « isomères »
Ex : un composé de formule brute C2H6O peut être un alcool : H3C – CH2 – OH alcool éthylique
Ou un éther : H3C – O – CH3 diméthyle oxyde
2) formule développer plane
Elle montre l’ordre de liaison des atomes dans une molécule
Ex H3C – CH2 – OH
H H
H – C – C – O – H
H H
Ca nécessite la connaissance de la valence des éléments pour le carbone valence 4 (il peut former 4
liaisons simples)
H
Ex : H – C – H
H H
2 simple et une double H – C = O

1 simple et 1 triple
Ex H – C ≡ N
2 doubles
Ex O = C = O
L’oxygène est bivalent O = O O2 ou H – O – H H2O
L’azote est trivalent : l’ammoniac H – N – H
H
L’hydrogène et les halogènes sont monovalents (H2) H – H, H – X (X = F, Cl, Br, ou I)
H – F acide fluorhydrique
H – Cl acide chlorhydrique
H – Br acide bromhydrique
H – I acide iodhydrique
Les liaisons simples sont dites saturées
Les liaisons multiples sont dites insaturées
3) Formule semi développée
En ne développe pas les liaisons “ C – H “ mais seulement les liaisons (C – C) ou “ C – Hétéroatomes
“
Ex méthanol H3C – CH2 – OH
4) formule simplifier plane
Pour simplifier la représentation des grosses molécules la chaine Hydrocarboné est représentée par
une ligne brisée
Les atomes d’hydrogène et de carbone n’apparaissent pas
Chaque cassure implique la présence d’un atome de carbone et chaque extrémité

Seuls les hétéroatomes figurent dans la représentation
Ex H3C – CH2 – CH2 – CH2 –CH3 pentane
H3C – CH2 – CH – CH3 2 methylbutane
CH3
H3C – CH2 – OH OH
CH2
CH2 CH2
CH2 CH2
CH2
CH2
CH2
CH2 = CH2 ==
CH2 = CH – CH3
H – C ≡ C – C – CH2 – CH3
O
O
Des écritures mixtes sont souvent utilisées
Ex CH2
CH2 CH2 – CH3
CH2 CH2

CH2
CH3
On distingue trois types de chaines hydrocarbonées
Chaîne carbonée linéaire
– C – C – C – C ……
Chaîne carbonée ramifiée
– C – C – C – C ……
– C – – C –
Chaine carbonée cyclique
CH2
CH2 CH2
CH2 CH2
CH2
Les composées à chaines linéaire ou ramifiées constituent la série aliphatique
 6
6
 7
7
1
/
7
100%