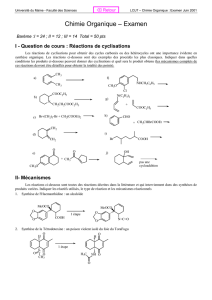
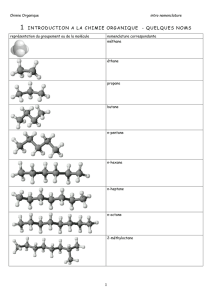
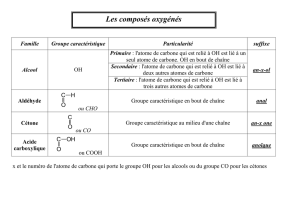
Rappels2

La chimie organique
I Qu’est-ce que la chimie organique :
La chimie organique apparaît d'abord dans l'histoire comme la chimie des composés du carbone et concerne les substances dont
l'origine est un être vivant, animal ou plante.
Les scientifiques pensaient, au début du XIXème siècle, que les corps “ organiques ” ne pouvaient être produits que par les
“ organismes ” végétaux ou animaux. Ceux-ci en effet auraient possédé une force spéciale, propre à la vie. Le chimiste n'était pas en
mesure d'insuffler, au cours d'une synthèse, aux éléments inanimés la force vitale qui leur faisait défaut. Cette pensée vitaliste est
à l'origine du retard que le chimiste avait pris dans la synthèse des corps organiques.
Il faut attendre1828 pour que soit réalisée la première synthèse d'une molécule dite organique : le chimiste allemand F. Wöhler
obtient alors de l'urée CH4N2O, identifiable à un échantillon authentique naturel, par décomposition thermique d'un composé minéral,
le cyanate d'ammonium. “ Je peux faire de l'urée sans avoir besoin de reins ou même d'un animal, fût-il homme ou chien ”, écrit
Wöhler.
L'essor de la synthèse de molécules organiques prend alors son élan. La complexité des structures a obligé très rapidement les
chimistes à étudier les liaisons entre les atomes constituants les molécules et à les représenter par des écritures conventionnelles
bien établies maintenant.
B. Vidal, « Histoire de la chimie » Coll. “ Que sais-je ? ”, n°35.
La chimie est traditionnellement divisée en 2 grandes parties : la chimie organique et la chimie minérale. La chimie organique traite
des composés du carbone. La chimie minérale traite des composés que forment entre eux tous les autres éléments. Quelques
composés simples du carbone (tels que CO, CO2, CO32-) sont toutefois considérés comme minéraux. Contrairement à ce que l’on
pourrait penser, le domaine de la chimie organique est beaucoup plus vaste que celui de la chimie minérale.. En effet, le carbone peut
se lier à lui-même de façon presque indéfinie, pour former des enchaînements extrêmement variés. Il suffit alors de quelques
autres éléments (H, O, N) pour former avec lui des millions de molécules différentes, dont le nombre d’atomes peut atteindre
plusieurs centaines de milliers (macromolécules). Tous les éléments, malgré leur diversité, ne forme qu’un nombre beaucoup plus
restreint de composés.
D’après le cours de chimie organique de Paul Arnaud
II Les hydrocarbures :
a) Exemples : Les hydrocabures sont des molécules constituées uniquement d’atomes de carbone et d’atomes d’hydrogènes :
Essence : C6H14 (hexane) + C7H16((heptane) + C8H18(octane) ….. Gaz de ville : CH4 (méthane)
Propane : C3H8 Butane : C4H10
GPL : C3H8 et C4H10 Essence de térébenthhine : C10H16
Isomères de constitution : molécules de même formule brute mais de formule développée différente.
b) Les alcanes :
Ce sont des hydrocarbures qui ne possèdent que des liaisons simples.
La chaîne linéaire de carbones la plus longue est celle qui identifie l’alcane :
Formule brute
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
nom
Méthane
Ethane
Propane
Butane
pentane
Hexane
Les groupes alkyles (groupes substituants) sont identifiés et nommés :
Groupe
Nom systématique
Groupe
Substituant
Nom de groupes alkyle
CH3
méthyle
méthyl-
CH2
CH3
éthyle
éthyl-
CH2CH2
CH3
propyle
propyl-
La chaîne principale est numérotée afin que le chiffre obtenu par l’ensemble des indices soit le plus bas et les groupes substituants
sont classés par ordre alphabétique sans tenir compte des préfixes multiplicatifs.
L’ensemble des indices le plus bas est celui qui, comparé à un autre ensemble d’indices, chacun classé par ordre croissant
(indépendamment de la nature des substituants), présente l'indice le plus bas au premier point de différence :
Soit sur cet exemple (2,3,5) au
lieu de (2,4,5)
CH
3CH
CH
3
CH
CH
2
CH
2CH
CH
3
CH
3
CH
3
12
34
5
6
CH
3CH
CH
3
CH
CH
2
CH
2CH
CH
3
CH
3
CH
3
1
2
34
56
3-éthyl-2,5-diméthylhexane
et non
4-éthyl-2,5-diméthylhexane
c) Les alcènes :
Hydrocarbures qui possèdent une (ou plusieurs) doubles liaisons. On parle alors de dérivés insaturés. Les composés ne possèdant pas
de double liaison seront dits insaturés.

La présence d’une double liaison est indiquée en remplaçant la terminaison « ane » du nom de l’alcane par la terminaison « ène ».
L’indice le plus bas posssible est attribué à la double liaison et seul l’indice le plus bas des deux atomes de la liaison double est cité.
Pen-2-ène : CH3 - CH2 - CH = CH - CH3
III Les dérivé halogénés :
L’intérêt de la double liaison dans un alcène est la possibilité d’une réaction addition au niveau de cette double liaison.
Le (E)-hex-2-ène peut par exemple réagir avec un hydracide (HF, HCl, HBr, HI) pour donner un dérivé halogéne le 2-bromohexane :
+BrH
Br +H
2
IV Les alcools :
La présence d’un halogène sur une chaîne carbonés facilité la réactivité de la molécule au niveau de halogène.
Pour le 2-bromohexane, dans certaines conditions, l’eau peut entraîner une réaction de substistution. On obtiendra alors un alcool :
l’ hexan-2-ol :
Br +OH2
OH +BrH
Une autre façon d’obtenir un alcool est l’hydratation des alcènes :
+OH2OH où bien
OH
La réaction inverse sera une déhydratation.
Un alcool est dit primaire lorsque le groupe hydroxyle (-OH) est rattaché à un carbone sur lequel sont fixés 2 hydrogènes.
Le carbone est secondaire lorsque le groupe -OH est rattaché à un carbone sur lequel est fixé 1 hydrogènes. Le carbone est
tertiaire lorsque le groupe –OH est rattaché à un carbone sur lequel aucun hydrogène ne sont fixés.
IV Les aldéhydes et les cétones :
L’hexanol est un réducteur. L’hexan-2-ol peut être oxydé en une cétone : l’hexan-2-one :
OH O
+oxydant +réducteur
L’hexan-1-ol peut être oxydé en un aldéhyde : l’hexanal :
+oxydant +réducteur
OH O
V Les acides carboxyliques :
L’acide carboxylique le plus connu est l’acide éthanoïque C2H4O2 composant principal du vinaigre.
Contrairement aux cétones, les aldéhydes peuvent être oxydés en acides carboxyliques. Ainsi l’hexanal s’oxyde en acide hexanoïque.
O+oxydant OH
O+réducteur
Importance de la position du groupe –OH pour un alcool :
un alcool primaire s’oxyde obligatoirement en un aldéhyde puis cet aldéhyde peut s’oxyder en acide carboxylique.
Un alcool secondaire peut s’oxydé pour donner une cétone. Celle-ci ne peut pas être oxydée en acide carboxylique.
Un alcool tertiaire ne peut s’oxydé ni en aldéhyde ni en cétone.
VI Les amines :
Le numéro atomique de l’azote est 7. Les amines sont des espèces basiques. Le doublet non liant de l’azote peut capter un proton.
On obtient alors un cation (ion ammonium) qui lui sera un acide.
VII Les polymères :
une macromolécules est une molécule géante possédant un enchaînement de plusieurs milliers ou dizaines de milliers d’atomes.

Un polymère est une macromolécule engendrée par la répétition, un très grand nombre de fois, d’une petite unité structurale appelée
motif.
Exemple : le polypropylène (n étant le nombre de fois ou le motif se répète)
CH CH2
CH3
CH CH2
CH3
CH CH2
CH3
CH CH2
CH3.................
Que l’on note
CH CH2
CH3
n
Le polypropylène peut s’obtenir par polyaddition d’un très grand nombre de molécules de bases identiques appelées monomères. Les
monomères comportent toujours au moins une double liaison C = C. Le monomère donnant lieu au polypropylène est évidemment le
propène : CH2 = CH – CH3
................. CH CH
2
CH
3
n
+ + ++
1
/
3
100%