Hémostase

Hémostase
L'hémostase est le mécanisme amenant à l'arrêt du
saignement lorsqu'un vaisseau a été blessé.
Lorsqu'un vaisseau sanguin est blessé, diverses étapes se
mettent en place.
La vasoconstriction est une réponse immédiate à la lésion d'un
vaisseau. Cela correspond à la "constriction" (contraction) du
vaisseau sanguin, le spasme vasculaire diminue le diamètre du
vaisseau et ralentit le saignement. La vasoconstriction dure 15 à
60 secondes et a pour effet de ralentir la circulation sanguine au
niveau du vaisseau déchiré et de permettre aux réactions
suivantes d'être pleinement efficaces.

•L'hémostase primaire se produit : les plaquettes se lient au
collagène des parois vasculaires exposées pour former un
amas, le clou plaquettaire de Hayem (Georges Hayem);
l'agrégation plaquettaire provoque l'adhésion des plaquettes
entre elles
•L' hémostase secondaire ou coagulation se produit. La phase
préparatoire de la coagulation est déclenchée par le contact
d'une protéine plasmatique, le facteur XII ou facteur Hageman
avec les tissus. La coagulation implique une cascade complexe
de facteurs de coagulation, ce qui débouche au bout du
compte en la transformation du fibrinogène, une protéine du
sang, en fibrine polymérisée, ce qui crée un caillot. Ce
processus dure 3 à 6 minutes après rupture du vaisseau

L'hémostase comporte 3 temps :
- le temps pariétal : composé du temps vasculaire et du temps
plaquettaire.
- le temps plasmatique.
- le temps thrombodynamique.

1. Le temps pariétal
-Le temps vasculaire
Vasoconstriction du vaisseau, afin de diminuer le flux sanguin au
niveau de la lésion.
-Le temps plaquettaire
- adhésion plaquettaire : les plaquettes adhèrent aux fibres de
collagènes du tissu conjonctif afin d'obstruer la brèche.
- agrégation plaquettaire : formation d'un caillot formé
essentiellement de plaquettes qui obstrue la brèche du
vaisseau et arrête le saignement, c'est le clou plaquettaire.

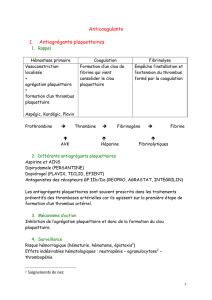
2. Le temps plasmatique
-le temps plasmatique est constitué par les phénomènes de coagulation et
aboutit à la formation d'un thrombus (caillot de fibrines) qui bloque le sang.
-la coagulation est due àla fibrine. La fibrine résulte de la transformation
d'une protéine, le fibrinogène. Cette transformation se fait sous l'influence de
la thrombine, ferment provenant de la transformation de la prothrombine par
la thromboplastine.
La coagulation comporte donc 3 étapes :
- la thromboplastinoformation : aboutit à l'élaboration de la thromboplastine.
-ne peut avoir lieu qu'en présence de calcium.
- résulte de l'interaction de facteur : facteur XII, XI, X, IX, VIII, V, III.
-la thrombinoformation : transformation de la prothrombine en thrombine
sous l'action de la thromboplastine :
•la prothrombine est synthétisée par les cellules du foie en présence de
vitamine K.
•ne peut avoir lieu qu'en présence de calcium.
•réaction accéléré par des activateurs : facteur VII, V.
•la fibrinoformation : c'est la transformation du fibrinogène en un réseau de
filament de fibrine.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%