Immunité muqueuse

L’immunité muqueuse
L3 Immuno-pathologie et immuno-intervention
2017
Patricia Amé-Thomas

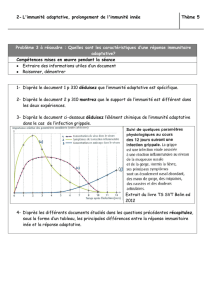
1. Introduction
•Muqueuses
–Interface de l’organisme avec l’extérieur
–+ de 400 m2 de surface d’échange
•Immunité naturelle
–Barrière physique (mécanique) : péristaltisme, cils, fluides
– Barrière chimique : acidité gastrique, sels biliaires…
–Barrière biologique : bactéries saprophytes intestinales
–Barrière cellulaire : immunité innée
•Immunité adaptative
–Cellules immunes et environnement particulier
–Balance tolérance (protéines alimentaires, flore
commensale) / réponse immune (pathogènes)
–Altérations = maladies inflammatoires du tube digestif

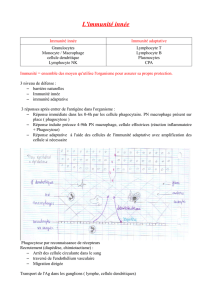
Non-soi
(pathogène, tumeur)
NK
NKT
Macrophages
gdT
PN
Complément
Immunité innée
Directement cytotoxiques (reconnaissance pathogènes ou soi altéré)
+ Déclenchement de la réponse adaptative
- Production de facteurs de danger (inflammation)
- Présentation de l’Ag (macrophages)
- Participation à l’activation des DC (molécules mb et solubles)
Rapide
Pas de récepteur
spécifique d’1 Ag
Pas de mémoire
Facteurs solubles et
cellulaires

1. Introduction
•Muqueuses
–Interface de l’organisme avec l’extérieur
–+ de 400 m2 de surface d’échange
•Immunité naturelle
–Barrière physique (mécanique) : péristaltisme, cils, fluides
– Barrière chimique : acidité gastrique, sels biliaires…
–Barrière biologique : bactéries saprophytes intestinales
–Barrière cellulaire : immunité innée
•Immunité adaptative
–Cellules immunes et environnement particulier
–Balance tolérance (protéines alimentaires, flore
commensale) / réponse immune (pathogènes)
–Altérations = maladies inflammatoires du tube digestif

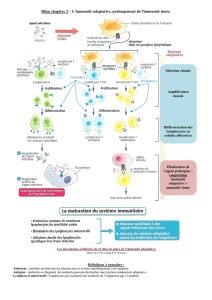
Migration
TCD4
Non-soi
(pathogène, tumeur) DCi
Migration
Maturation
Capture de l’Ag
Contexte de danger
Ag soluble Corps
apoptotiques
DCm
Activation
réciproque
Présentation de peptides
dans le CMH de classe II
IFN-g
TNF
TCD8
CTL
Présentation de peptides
dans le CMH de classe I
IL-4
IL-10
B
Th2 TFH
IL-21
PNE
Mastocytes
IL-5
IL-9
IL-12
Migration
Migration Th1
IL-4
I_ Reconnaissance/Capture de l
’
Ag
II_ Activation d
’
effecteurs spécifiques
III_ Phase effectrice
Immunité
adaptative
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%