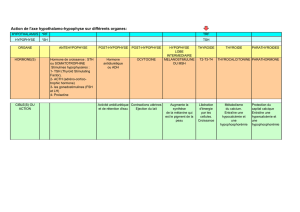
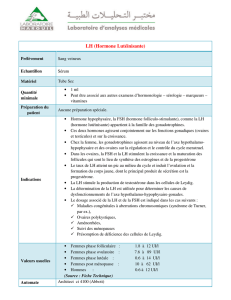
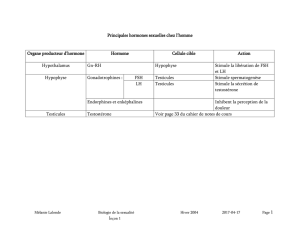
Régulation différentielle de l`expression des gonadotropines (LH et

THESE DE DOCTORAT DE
L’UNIVERSITE PIERRE ET MARIE CURIE
Spécialité : Physiologie de la Reproduction
Présentée par
Salima AROUA
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE PIERRE ET MARIE CURIE
Régulation différentielle de l’expression des gonadotropines (LH
et FSH) chez l’anguille européenne, Anguilla anguilla
Soutenue le 9 juillet 2008
JURY
- Mme Le Gac Florence, DR INRA, Rennes Rapporteur
- Mr Kah Olivier, DR CNRS, Univ. Rennes Rapporteur
- Mr Boeuf Gilles, PR UPMC, Banyuls Examinateur
- Mr Counis Raymond, DR CNRS, Paris Examinateur
- Mr Elie Pierre, DR Cemagref, Bordeaux Examinateur
- Mme Dufour Sylvie, DR CNRS, MNHN Directeur de thèse
tel-00811792, version 1 - 11 Apr 2013

REMERCIEMENTS
Dans un premier temps, je voudrais remercier les membres du jury, Madame Florence Le Gac
et Monsieur Olivier Kah qui ont accepté « d’endosser les rôles de rapporteurs », ainsi qu’à
Messieurs Gilles Boeuf, Pierre Elie et Raymond Counis qui m’ont fait l’honneur d’accepter
de participer à mon jury de thèse et d’évaluer mon travail.
J’adresse mes plus sincères remerciements à Madame Sylvie Dufour qui m’a formée,
coachée, supportée, aidée et motivée au cours de toutes ces années passées au sein de son
laboratoire. Ce fut un réel plaisir, j’y ai appris énormément sur le plan scientifique comme sur
le plan humain.
Un grand merci également à l’ensemble de l’équipe qui m’a accueillie en son sein : à Nadine
qui m’a formée à la culture cellulaire et qui dans les derniers mois a été un de mes nombreux
coachs ; à Karine pour son aide et son soutien au cours des périodes de rédaction et en
dehors ; à Bernadette et Sylvie pour les travaux d’histologie et les dosages hormonaux, pour
bonne humeur quotidienne (ou presque) et pour les nombreuses discussions et fous rires
partagés ; et à Marie-Emilie avec qui j’ai partagé le « bateau de la thèse ». Merci, merci,
merci.
Je voudrais également exprimer ma reconnaissance à Madame Monika Schmitz qui m’a
initiée à la biologie moléculaire, il y a quelques années de cela et qui, tout au long de mon
parcours, m’a procuré de judicieux conseils. J’espère pouvoir en profiter encore longtemps.
Merci également à Monsieur Finn-Arne Weltzien qui a su, avec douceur et sagesse, me faire
pousser les portes de la PCR quantitative en temps réel…. Et qui, par la suite, m’a si
gentiment reçu au « pays des Vikings ».
Au cours de ces années, j’ai pu rencontrer une multitude de personnes avec lesquelles j’ai pu
échanger et m’enrichir tant d’un point de vue scientifique, que d’un point de vue humain.
Donc merci à l’équipe des Céphalos : Laure, Aude, Sébastien, Yann, Sandra et tous les gens
de passage pour ces petits-déjeuners studieux qui m’ont appris et m’apprennent encore, au fur
et à mesure, à améliorer mes discours au public.
Merci aux copains thésards ou jeunes docteurs: Gersende, Cécile, Hélène (la
« Cemagrefienne »), Anne-Gaëlle, Eric, Patrick (alias « speedy gonzalez »), Marie-Emilie,
Jean-Baptiste, Stéphanie, Sandra et tous les autres qui, partageant les mêmes angoisses,
épreuves, difficultés, mais aussi motivations et joies, m’ont permis d’avancer ; et aux
« autres » docteurs : Catherine, Miskal, Marthe,… qui me montrent que tout est possible.
Merci à tous les habitants (ou ayant habité) du 7 rue Cuvier. Merci pour les pauses-café et les
déjeuners dans la ménagerie, merci pour la bonne humeur quotidienne, merci pour le soutien ;
bref, je suis vraiment heureuse d’être passée par là.
Merci aux amis et amies qui m’ont soutenue et motivée pendant tout ce temps, m’écoutant
patiemment leur parler du cycle de vie de l’anguille, de mes travaux en cours ou encore de
mes chers élèves ; ça n’a pas dû être facile, je vous félicite donc pour cela et vous remercie du
fond du coeur….
tel-00811792, version 1 - 11 Apr 2013

Et bien sûr, un grand grand merci à ma famille. Mes sœurs, Saida, Karima et Lila, mes frère et
beau-frère, Salim et Jean-Marc, mes parents Mohand et Chala, et les nouveaux arrivants
Salma et Yanis qui m’ont porté et ont cru en moi tout au long de mon parcours.
Enfin, j’aimerais dédier ce travail à tous les miens et plus spécialement à mon grand père
Abdellah Aroua qui m’a appris que la patience et la sagesse étaient les plus sains objectifs à
atteindre.
tel-00811792, version 1 - 11 Apr 2013

Liste des publications et communications réalisées pendant la formation doctorale
Articles publiés:
Schmitz M, Aroua S, Vidal B, Le Belle N, Elie P, Dufour S, 2005. Differential regulation of
luteinizing hormone and follicle-stimulating hormone expression during ovarian development
and under sexual steroid feedback in the European eel. Neuroendocrinology 81: 107-119.
Aroua S, Schmitz M, Baloche S, Vidal B, Rousseau K, Dufour S, 2005. Endocrine evidence that
silvering, a secondary metamorphosis in the eel, is a pubertal rather than a metamorphic event.
Neuroendocrinology 82: 221-232.
Sbaihi M, Kacem A, Aroua S, Baloche S, Rousseau K, Lopez E, Meunier F, Dufour S, 2007. Thyroid
hormone-induced demineralisation of the vertebral skeleton of the eel, Anguilla anguilla. Gen
Comp Endocrinol. 151(1): 98-107.
Aroua S, Weltzien F-A, Le Belle N, Dufour S, 2007. Development of real-time RT-PCR assays for
eel gonadotropins and their application to the comparison of in vivo and in vitro effects of sex
steroids. Gen Comp Endocrinol. 153(1-3): 333-343.
Article en préparation:
Aroua S, Baloche S, Le Belle N, Rousseau N, Dufour S. Activin differentially regulates luteinizing
hormone and follicle-stimulating hormone expression by eel pituitary cells.
Chapitres de livre:
Rousseau K, Aroua S, Schmitz M, Elie P, Dufour S. Silvering: metamorphosis or puberty ? In
‘Migration and Reproduction of the European eel’ (G. van den Thillart, S. Dufour, C. Rankin,
eds), Springer Publisher (sous presse).
Aroua S, Rousseau K, Schmitz M, Chang CF, Dufour S. Positive and negative regulations of
endogenous brain gonadoliberins and pituitary gonadotropins during eel artificial maturation. In
‘Migration and Reproduction of the European eel’ (G. van den Thillart, S. Dufour, C. Rankin,
eds), Springer Publisher (sous presse).
Communication orale:
Aroua S, Schmitz M, Weltzien F-A, Baloche S, Le Belle N, Rousseau K, Dufour S, 2006. Differential
expression of LHbeta and FSHbeta in European eel, Anguilla anguilla. Proceedings of the 23rd
Conference of European Comparative Endocrinologists, Manchester, England. Abstract book p.
64, oral communication (O79).
Communications affichées:
Aroua S, Sbaihi M, Huang Y-S, Le Belle N, Dufour S, 2007. Synergistic action of androgens and
cortisol on gonadotropin regulation in European eel, Anguilla anguilla. Proceedings of the 8th
International Symposium on Reproductive Physiology of Fish in Saint Malo, France. Abstract
book p. 118, poster communication (P27).
Aroua S, Le Belle N, Schmitz M, Dufour S, 2007. In vitro regulation by activinB and IGFI of
gonadotropin expression in European eel, Anguilla anguilla. Proceedings of the 8th
International Symposium on Reproductive Physiology of Fish in Saint Malo, France. Abstract
book p. 119, poster communication (P28).
tel-00811792, version 1 - 11 Apr 2013

Principales abréviations
11-KT: 11-kétotestostérone
CA: catécholamine
DA: dopamine
DHP: 17!,20"-dihydroxy-4-pregen-3-one
DHT : dihydrotestostérone
E2 : oestradiol
EIA - ELISA: dosage immuno-enzymatique
F : Cortisol
FSH : hormone folliculo-stimulante (follicle-stimulating hormone)
FSH" : sous-unité " de la FSH
GH : hormone de croissance (growth hormone)
GnRH : gonadolibérine (gonadotropin-releasing hormone)
GP : hormone glycoprotéique
GP! : sous-unité ! des hormones glycoprotéiques
hCG : gonadotropine chorionique humaine
IGF : facteur de croissance de type insuline (insulin-like growth factor)
IO : index oculaire
LH : hormone lutéinisante (luteinizing hormone)
LH" : sous-unité ! de la LH
HPLC : chromatographie liquide haute pression
NA : noradrénaline
NPOav : noyau préoptique antéroventral
POA : aire préoptique
PRL : prolactine
qrt RT-PCR: PCR quantitative en temps réel
RIA: dosage radio-immunologique
RGS - GSI : rapport gonadosomatique (Poids des gonades / Poids total du corps)
RTDS – DSI : rapport tractus digestif-somatique (Poids du tractus digetif/ Poids total du corps)
T : testostérone
T3 : triiodothyronine
T4 : thyroxine
TSH : hormone thyréostimulante (thyroid-stimulating hormone)
TH : tyrosine hydroxylase
Vtg : vitellogénine
tel-00811792, version 1 - 11 Apr 2013
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
 227
227
 228
228
 229
229
 230
230
 231
231
 232
232
 233
233
 234
234
1
/
234
100%