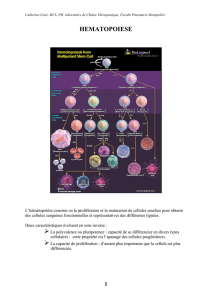
Facteurs de croissance leucocytaires

Lignée blanche Etat des lieux des connaissances et Synthèse Observatoire Cancer BPL V0
1
Facteurs de croissance leucocytaire G-CSF
Etat des lieux et synthèse
!"#$%&'
%((('un état des lieux sur l’utilisation des
facteurs de croissance de la lignée blanche en inter région ainsi qu’une synthèse des
informations existantes à destination de la communauté médicale)
(( ' (( '
*' *+ (, (-
(((,.)(
( *+ -- ( / $% ! 0%
1!01&)
2(%$%&
3$%%*3%
!%%* 145
!!%/0$
67!%"
!2% %,*0
82$
/390
8/0$
6%%39$
43%3!07
4%39$
2"
3%394
0%"4
/13%39/%
/#(3%39$
67#"
0
( (: %(
(*)
%/ % $% !01
&*--*+&-(
)

Lignée blanche Etat des lieux des connaissances et Synthèse Observatoire Cancer BPL V0
2
Sommaire
"/0 ))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))) ;
/" )))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))));
$%))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))<
0))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))<
!03/1 )))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))=
""0 ))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
/ -- ))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
$ --)))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))>
!)))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
"""))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
/?%@( ))))))))))))))))))))))))))))))))))))))))))))))))))))
$?-&)))))))))))))))))))))))))))))))))))))))))))))))))
?% )))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
" *+: )))))))))))))))))))))))) A
/(@(, )))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))A
$((,. )))))))))))))))))))))))))))))))))))))))))))))))))))=
0*+/$B!01)))))))))))))))))))))))))))))))))))))))
/!01 ))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
$/$% ))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
$%()))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
Synthèse
-&/(:
@0(-((%%
. ( &C * & &&(*:
8%((''(%-%ou(&C%
@(&%--13:
-%(('
%
@(%:
-%(('%
@ 4( , %' &* (*
-% ((
@4(-"3:
-%((
-/*()
La neutropénie fébrile présente un risque pour le patient et doit être surveillée.
Aussi,l’usage des facteurs de croissance leucocytaire est bien défini pour certains
protocoles à risque de 20 % neutropénies fébriles d’une part et pour certains
patients présentant des critères précis pour les protocoles à risque entre 10 et 20%
d’autre part.
-*(D%(%.<*
( + &* ( (
(E, 0# (6-F

Lignée blanche Etat des lieux des connaissances et Synthèse Observatoire Cancer BPL V0
3
En prévention primaire, ces facteurs de croissance n’ont pas d’effet sur la survie
globale E$% 1(( )' $ ! 1& 0) ='
$$63)
>'3G/)
F)
218%&E(-B--F&&
EF ( * % &C E/
$=F)
218%,(44%=.
E.(&%*.<FE151H=<I$HH<F
(-4(((*
+(%*%)
*( 8& , ' . & (( HH (' *
( ( . *
&(( * + ( (
E 6F)
En pratique, l’enquête auprès des pharmaciens et des cliniciens (oncologues,
hématologues, spécialistes) des régions Bretagne et Pays de la Loire en 2013 révèle
que :
(%@(,()
(*(,*(()&
.A%*)
' ( ( ( ( J
((218'-*((>.;J->>J)
' - (- (% ( (*'
(-)/'*-,(+((
-%-)
('K-*(
+(((-*,*K-)
(& (- - E
F)((--(-*+
(+)
((4)&((
-*.<%)
( (* *. - ( * @:
%'H.L-*.>L()
Calcul du coût standard : ((*.<M%'-
-(*-*:4
;L'4(%
HL'2&
:A=L':><.<L)
Enquête auprès des Directions Régionales du Service Médical DRSM PL et assurance
maladie B
'>'?&(((>L((%-%';L
( %' L ( -% E L ( (( ; L (
F)
>' - ( J (( 2 18' -
*((>A.J->.>=J)
En conclusion, la prescription d’un G CSF est définie par des recommandations
internationales. Le praticien dispose d’une meilleure maitrise des bénéfices, risques
et des coûts avec une forme quotidienne par rapport à la forme retard sous réserve
du suivi du patient (bilans sanguins).
En 2013, en B PL, les biosimilaires ne représentent en ville que 20% des
prescriptions de l’ensemble des G CSF.

Lignée blanche Etat des lieux des connaissances et Synthèse Observatoire Cancer BPL V0
4
I AMM Recommandations
2@18N2&@&1%8
A Indications
(
2@18
- -%4(%
/%/HH
- %2&
%HH>%&&
-
% 15 @ 1%@% HHA
- (%-%4
/%(%E-%2@
18.O(&&,@%& 2F
- -%EP5
15'4
3('0%
0(
#%
#FH
/
":(-@
"(%%:
- (&%--13
- 13E%--F
- (,%'&*(*
- (-"3
@0(-((%%
. ( &C * & &&(*:
8%(('(%-%E*(-F
(&C:%)
@ ( & %-- 13:
-% (( '
%E(&CF
@13E%--F:
-%(('%
@ 4( , %' &* (* K-
,
-%((
@4(-"3:
-%((
2@18*-%'(%-%%-2@
18)
-% (%-% - ( (
* K/!4 EQF) %' * . '
((*K/!4K)
2@18 (&%* &M * %& %
&E!$HHF)+('
E/$=F)
%(C,(2@18-(()
2@18(*%(---&E
& (% * - &&( (&
( 44F) " & % ( (
(-(&%**A.E151H=<I$HH<F)
2@18(*%&&44
(;B.;E151H=<I$HH<I)
4/191/H=HF)2@18(%(%

Lignée blanche Etat des lieux des connaissances et Synthèse Observatoire Cancer BPL V0
5
%(E$%&$ H=<IR
4HHI $HHI0#-HHF)
,.%(
%) -- 2@18 ( ( . ( (-*
E2180F E "& HH<F) ( ( %
%&' ( (% &C * (
E/
$
HHI$
HH<IQG
$63
HH>F
"(.-E/$=F)
2@180%((,
(%2@180.-'((.((
E/
$
HHI /
$
HH<I $
$
H=HI 35
( 3
HHF)
2@18.(&M&(*-
( * , E!
$
HHI
/
$
=I /
$
HH<F) " * 2180
+ ( ( % ( %* ( E( E/
$
=I /
$
HH<F) ( 2@18@2@180
((%E-
40
F)
/ (&%*' ( ( (
(% -%EF( 2@18I
S%-%(C,(
2@18)('*(%'
2@18 '
%(C,')E&$H=HI#M//%HH<I
#//%HHHF)
(*' 2@18 ( (-
E$%%R')
03)
H'G-6
4 %6)
HH%
6
)F
2@18 ( + ( (
&(()
$:- E/41>F
9(%*)/*
*(%*
*' (( ( ( ( %
**)
9 . %* E ( .
( % @F - *
() ( ((* . ( %*
()./%
(E /F)
( ( ( (
(*(%('(*
(( , E- %F'
()
/41(G)
/% (.(*
(,(
%
5%)/-.((
(' * ( &M E ' 2@18F
'
%
(-*)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%