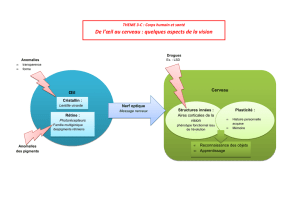
Les anomalies héréditaires des bovins laitiers

Les anomalies héréditaires
des bovins laitiers
Marion Ferrand
Audrey Fraipont
Carine Gantier

•500 affections génétiques décrites chez les bovins.
•Populations bovines sélectionnées → émergence
d’anomalies génétiques dont le B.L.A.D., le C.V.M. et
l’achondroplasie.
• D’où nécessité d’une gestion efficace de ces anomalies.

Mécanismes de la transmission
héréditaire:
•Déterminismes monofactoriels simples ou
mendéliens:
–Déterminisme autosomal récessif: représente 60% des
anomalies héréditaires. Seuls les animaux homozygotes
pour la mutation aa expriment la maladie.
–Déterminisme autosomal dominant: représente 20% des
anomalies héréditaires. Les animaux de génotypes Aa et
aa expriment l’anomalie.
– Hérédité liée à l’X: cas rares dans l’espèce bovine. Le
locus morbide est porté par le chromosome X.

•Déterminismes génétiques complexes:
–Néomutations: la mutation apparaît de novo dans les
gamètes d’un individu sain, et des individus atteints sont
retrouvés dans la descendance.
–Pénétrance incomplète et expressivité variable: la
pénétrance correspond au % d’individus génétiquement
prédisposés qui expriment réellement l’anomalie.
L’expressivité est dite variable lorsque des individus qui
ont un statut génétique identique en un locus morbide
particulier peuvent exprimer la maladie à des degrés
divers.
–Hétérogénéité génétique: 1 même anomalie peut être due
à des mutations qui affectent différents gènes.
–Empreinte génomique parentale: tableaux cliniques
différents selon la transmission par le père ou la mère de
la mutation.
–Hérédité polygénique: intervention de nombreux gènes
dont 1 ou quelques uns ont 1 effet suffisamment fort pour
être mis en évidence.

•Les anomalies héréditaires sont principalement dues à
des mutations.
•Taux de mutation spontanée très faibles: 10-4 à 10-8.
•=> tout individu normalement constitué soit porteur, en
espérance, de quelques mutations.
• L’utilisation d’un individu comme reproducteur contribue
à diffuser les mutations dont il est porteur →
augmentation de leur fréquence au sein d’une
population. Ce genre de sélection contribue à augmenter
le taux de consanguinité dans la population. Or la
consanguinité augmente la probabilité d’apparition des
anomalies dues à des gènes récessifs.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%