électron - Teach Nuclear

Qu’est-ce que la radioactivité?

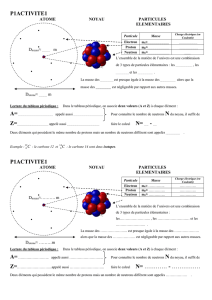
Le noyau renferme des
protons et des neutrons
L’électron tourne en
orbite autour du noyau
Proton : Charge
positive, nombre de
masse de 1
Neutron : Charge
neutre, nombre de
masse de 1
Électron : Charge
négative, nombre de
masse près de 0
Aperçu du noyau
Charge neutre
Charge négative
Charge positive
Neutron
Électron
Proton

B
9
5
•La notation atomique
donne tous les
renseignements utiles sur
la structure de l’atome
•Pour le bore
5 protons
5 électrons
•Nombre de masse = 9
4 neutrons
Symbole atomique
Numéro atomique (nombre de protons)
Nombre de
masse
Notation atomique

À l’aide du tableau périodique, trouvez les renseignements
ci-après pour chaque atome des éléments suivants :
numéro atomique
nombre de protons
nombre d’électrons
nombre de masse
nombre de neutrons
notation atomique
1) baryum 2) uranium 3) chlore
Une mine de renseignements

Baryum Uranium Chlore
Numéro atomique 56 92 17
Nombre de protons 56 92 17
Nombre d’électrons 56 92 17
Nombre de masse 137 238 35
Nombre de neutrons 81 146 18
Notation atomique
Ba
137
56
U
238
92
Cl
35
17
Réponses
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%