Pour les professeurs de la 3ème B

Conductance et
Conductivité d’une solution
ionique
Objectifs :
Une solution ionique est conductrice.
Connaître la relation entre résistance et conductance et les grandeurs influentes, celle entre conductance
et conductivité.
Savoir tracer et utiliser une courbe d’étalonnage de la conductance en fonction de la concentration.
Savoir utiliser la relation entre conductivité, conductivité molaire ionique et concentration.
I) L’électricité en chimie :
1) Les solutions conductrices :
Dans une solution ionique, le courant électrique est du à une double circulation d’ions : les cations se dirigent
vers l’électrode reliée à la borne négative du générateur et les anions vers l’électrode reliée à la borne positive
du générateur. Dans ce cas, cette solution conductrice est appelée solution électrolytique ou électrolytique.
La quantité de courant électrique devient importante (= I) lorsque la vitesse des porteurs de charge augmente ou
si le nombre de porteurs de charge augmente.
2) La loi d’ohm :
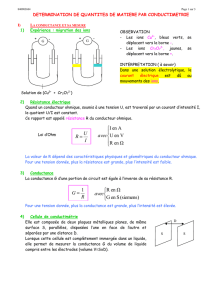
On prend deux électrodes reliées à un générateur plongées dans une solution électrolytique, on applique une
tension U aux bornes de ces électrodes et on mesure l’intensité qui parcourt ce circuit. On s’aperçoit que cette
tension est proportionnelle à l’intensité I d’où la loi d’ohm.
U = R x I
R =
I
U
II) Conductance d’une solution ionique :
1) Définition :
En conductimétrie, on mesure la conductance d’une portion de solution électrolyte.
La conductance d’une portion de solution électrolyte est, par définition, égale à l’inverse de la résistance de la
même portion
G =
R
1
=
U
I
avec G : la conductance en Siemens (S), R la résistance en ohm (Ω).

2) Influence de différents facteurs sur la mesure de conductance :
TP conductance d’une solution ionique partie 1.
La conductance d’une solution électrolyte peut donc être déterminée par la mesure de la tension aux bornes des
de deux électrodes placées dans cette solution et de l’intensité qui parcourt alors ce circuit. Pour que la mesure
soit correcte, on doit utiliser une tension variable alternative sinusoïdale.
Voyons les différents facteurs pouvant influencer la valeur de la conductance :
La surface immergée S des électrodes :
Consigner les résultats dans un tableau donnant H (hauteur d’immersion), S (surface immergée), I, U et G. l est
la largeur des électrodes (avec l = 2,3 cm).
H (cm)
S = H x l (cm2)
I (mA)
U (V)
G =
U
I
(mS)
1,0
2,0
3,0
4,0
5,0
Conclure : quand s augmente, G augmente. S est proportionnelle à G
La distance L séparant les deux électrodes :
Réaliser 4 mesures de I et de U en faisant varier de 1,0 à 4,0 cm la distance L entre les électrodes.
L (cm)
I (mA)
U (V)
G =
U
I
(mS)
1,0
2,0
3,0
4,0
Conclure : plus L augmente, plus G diminue. L est inversement proportionnelle à G.
La température θ.
Noter la température θ, l’intensité I et la tension U.
θ (°C)
I (mA)
U (V)
G =
U
I
(mS)
Conclure : la conductance augmente avec la température.
En immergeant toujours la cellule sur une même hauteur, mesurer I et U pour les 3 solutions aqueuses de
chlorure de sodium (Na+ + Cl-), de chlorure de potassium (K+ + Cl-) et de soude (Na+ + HO-).
Solution aqueuse
I (mA)
U (V)
G =
U
I
(mS)
Na+ (aq) + Cl- (aq)
K+ (aq) + Cl- (aq)
Na+ (aq) + HO- (aq)
Conclure : G dépend de la nature de la solution ionique
La concentration molaire de la solution électrolytique : voir III.
III) Influence de la concentration sur la conductance : détermination de
la concentration d’une solution inconnue :
TP : conductance d’une solution ionique.
Cette technique est un dosage par étalonnage, cette technique est nos destructive.

IV) Conductivité d’une solution électrolytique :
1) Définition :
On a vu que la conductance est proportionnelle à la surface immergée des électrodes et inversement
proportionnelle à la distance entre les plaques donc on peut écrire :
G = K x S/L. La constante K est notée σ et est appelée conductivité de la solution.
Donc
G = σ x
L
S
G : conductance en siemens (S), S surface en m², L distance entre les électrodes en m et σ : la conductivité
de la solution en S.m-1.
La conductivité peut aussi s’exprimer en S.cm-1.
La conductivité représente l’aptitude d’une solution à conduire le courant électrique. Elle est
caractéristique de la solution c'est-à-dire qu’elle ne dépend pas du matériel utilisé pour effectuer la
mesure.
Pour déterminer expérimentalement la conductivité, il suffit de connaître la valeur de la conductance, de la
surface immergée des électrodes et la distance qui les sépare.
2) Facteurs influant sur la conductivité d’une solution d’un soluté unique :
La température : σ augmente quand θ augmente.
La nature des solutions : σ dépend de la nature de la solution.
La concentration molaire en soluté apporté (c) des solutions : σ augmente quand c augmente.
1
/
3
100%