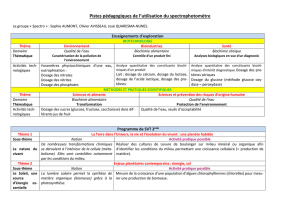
Techniques expérimentales en chimie organique

Techniques expérimentales en chimie organique
Montage à reflux
Permet de chauffer un milieu réactionnel (raisons cinétiques et/ou
thermodynamiques) sans pertes de matière
Garde à chlorure de calcium
Au-dessus du réfrigérant à eau pour piéger l’eau de l’atmosphère
Dean-Stark
Entraînement hétéroazéotropique de l’ eau en créant un hétéroazéotrope (Teb la
plus basse du diagramme) avec solvant non miscible à l’eau comme toluène,
cyclohexane. Permet de déplacer un équilibre dans le sens de formation d’eau :
acétalisation, estérification.
CCM
Permet d’analyser un mélange réactionnel : pureté d’un produit, suivi d’une
réaction, élaboration d’une chromatographie sur colonne (voir plus loin)
Technique qui repose sur la différence d’affinités d’un constituant vis-à-vis d’une
phase liquide mobile par capillarité (éluant = mélange de solvants) (solubilité) et
les affinités avec une phase solide fixe (silice par exemple) (phénomènes
d’adsorption). Selon l’intensité relative de ces affinités, le constituant migrera
plus ou moins haut (rapport frontal) le long de la phase fixe. La révélation permet
de mettre en évidence les différents constituants du mélange.
Isolement d’un brut (pas encore purifié) : deux cas
Filtration sous vide : Bücner
Le produit précipite dans le milieu réactionnel (non soluble). On filtre dous vide
sur Büchner ou verre fritté (en fixant la fiole à vide) pour récupérer le solide
brut.
Le produit est soluble dans
le milieu réactionnel
Extraction liquide-liquide (ampoule à décanter). On choisit un solvant non
miscible au milieu réactionnel dans lequel le produit voulu est plus soluble. On
extrait 3 fois la phase d’origine (aqueuse souvent) par le solvant d’extraction. On
réunit les phases organiques obtenues (qui contiennent le produit), on les lave
(pour neutraliser des H+ ou HO-) puis on sèche la phase organique sur sulfate de
magnésium anhydre.
Après filtration sur coton( !) du desséchant, on évapore rapidement le solvant sous
vide à l’évaporateur rotatif. Le produit brut est ainsi isolé sous forme d’un solide
ou d’un liquide.
Purification du produit brut
Purification d’un solide
Recristallisation : Montage à reflux
Technique qui repose sur la différence de solubilité du produit et de ses impuretés
dans un solvant donné. On choisit un solvant dans lequel le produit est soluble à
chaud (reflux du solvant) mais insoluble à froid ( recristallise à froid). Les
impuretés, elles, sont solubles à chaud et à froid. En filtrant sous vide on
récupère le solide, les impuretés restent en solution.
Purification d’un liquide
Distillation fractionnée efficace si le mélange ne conduit pas à des
homoazéotropes (dans ce cas on ne peut séparer totalement les deux
constituants). Les températures d’ébullition des composés doivent être très
différentes Δ T> 10°C
Purification solide et liquide
Chromatographie sur colonne : idem à la CCM mais la silice est déposée dans une
colonne. Le produit brut est déposé sous forme liquide (en haut de colonne), on
entraîne ce mélange liquide (élue) à l’aide de solvants de polarités croissantes. Le
constituant le moins polaire sort en premier de la colonne (moins retanu par la
silice polaire) , ensuite les constituants polaires plus retenus sur la silice. Il y a
séparation des différents constituants (récupérables séparément) et donc
purification du liquide initial
Identification d’un produit
Solide
Point de fusion : Banc Köfler
Liquide
Indice de réfraction nTD = 1,.... avec réfractomètre d’Abbe
Température d’ébullition sous P mesurée lors de purification par distillation
Tout composé
Spectroscopies IR et RMN 1H

Différents dosages en chimie analytique
Dosage volumétrique
I2 dosé par thiosulfate S2O32-
Indicateur coloré de pH, d’oxydoréduction,
complexation…
I2 + amidon = complexe bleu-violet
Dosage Potentiométrique à courant nul (pas de générateur)
Millivolmètre et deux électrodes
Electrode de référence
ECS ou Ag/AgCl/Cl-//
Electrode indicatrice
Dosage pH-métrique
pH-mètre = millivolmètre étalonné en pH avec deux
solutions tampons
Electrode au calomel
Electrode de verre
Dosage oxydoréduction
Dosage des ions chlorure par nitrate d’argent
Dosage des ions Fe2+ par Ce4+
Electrode au calomel avec
protection
allonge au nitrate de
potassium
Electrode au calomel
Electrode d’argent
Electrode de Pt
Dosage potentiométrique à courant non nul (Voir exercice avec Hg2+ et Y4-)
Dosage conductimétrique
La réaction de dosage doit faire intervenir des ions
conductimètre = Ohmmètre
[S.m -1] σ = f(V)
H+conduit mieux puis HO-
Dosage spectrophotométrique
Spectrophotomètre avec rayonnement incident UV-
Visible
Loi de Beer- Lambert A = ε l C à λ fixé
Dosage polarimétrique
Loi de Biot
α = [α] l C dépend de T, et rayonnement (D)
D = doublet du sodium 589 et 589,5 nm
1
/
2
100%