05/11/2013 NGUYEN Jessica L2 BMCP Pr R. PLANELLS 22

BASES MOLÉCULAIRES ET CELLULAIRES DES PATHOLOGIES – Intégration des métabolismes
05/11/2013
NGUYEN Jessica L2
BMCP
Pr R. PLANELLS
22 pages
Intégration des métabolismes
1/22
Plan
A. Introduction
I. Définition
II. Métabolisme énergétique
III. Régulation des métabolismes
B. Les sources d'énergie
I. Diversité et complémentarité des sources d'énergie
II. Les différentes sources d'énergie
III. L'acétyl-coA mitochondrial
IV.La pyruvate déshydrogénase
V. Transfert des acides gras dans la mitochondrie
VI. Schéma général des interconversions
VII. Le cycle de Krebs est alimenté par le catabolisme des acides aminés
VIII. Le rôle des transaminases dans les transports mitochondrie → cytosol
IX. Le cycle de Krebs est régulé par le rapport ATP/ADP
X. Acétyl-coA mitochondrial et cytoplasmique
C. Choix des sources d'énergie
I. Régulation de la glycolyse
II. Régulation de la β-oxydation
D. Mobilisation des réserves
I. Mobilisation du glucose à partir du glycogène (voie de la glycogénolyse)
II. Régulation de la glycogénolyse
III. Néoglucogenèse
IV.Régulation de la néoglucogenèse

BASES MOLÉCULAIRES ET CELLULAIRES DES PATHOLOGIES – Intégration des métabolismes
A. Introduction
I. Définition
Le métabolisme est l'ensemble des transformations moléculaires et des transferts d’énergie qui se déroulent de
manière ininterrompue dans la cellule ou l’organisme vivant.
C’est un processus qui fait intervenir des réactions de dégradation des molécules de l’environnement
(catabolisme, par oxydation de matériel) pour synthétiser les molécules propres de la cellule ou de l’individu
(anabolisme).
On ajoute à cela la notion de métabolisme intermédiaire qui implique la notion d'échange avec
l'environnement.
II. Métabolisme énergétique
Toutes les cellules ont besoin d’énergie continuellement (notamment pour maintenir le gradient de sodium
dans la cellule). Mais aussi, de manière brutale, elles peuvent avoir besoin de beaucoup d’énergie (en particulier
les cellules musculaires).
A l’opposé, la fourniture d’énergie est discontinue . Elle est abondante à la fin d’un repas (post-prandial), elle
est rare en période de jeûne.
Gérer la disponibilité de l’énergie en fonction des besoins est le fait d’un ensemble de mécanismes au niveau
de :
- La cellule, qui doit capter (choisir) une source énergétique et à partir d’elle produire l’ATP.
- L’organisme qui va stocker, puis libérer les molécules riches en énergie et les distribuer aux différentes
cellules en fonction de leurs besoins.
- L’espèce s’adapte (à très long terme) à l’accessibilité aux sources d’énergie (aliments abondants ou
rares ; exemple de la révolution agricole d'il y a 17-18000 ans qui a changé profondément le mode
d'alimentation).
Il faut avoir la bonne énergie, au bon endroit et au bon moment : gérer la disponibilité de l'énergie est donc tout
l'enjeu du métabolisme.
III.Régulation des métabolismes
Les différentes régulations du métabolisme vont donc être mises en place à différents moments :
- A court terme, des régulations enzymatiques vont orienter le fonctionnement cellulaire vers la
production ou l’épargne d’énergie (par exemple, si le foie reçoit du glucose et des acides gras, il va
stocker le glucose et utiliser les acides gras. Au contraire, dans une cellule musculaire, on va plutôt
utiliser le glucose en premier et stocker les acides gras)
- A moyen terme, en tenant compte des préférences de chaque cellule, la gestion de la source d’énergie
(exogène en post-prandial ou endogène à l’état de jeûne)
- A long terme, l’adaptation aux régimes alimentaires grâce à la régulation des quantités d’enzymes
(régulation des transcriptions)
- A très très long terme, celle de l’adaptabilité aux conditions environnementales par sélection des
variants génétiques (chacun des gènes est variable, et les variants sont plus ou moins efficaces. En
fonction de l'alimentation, certains variants vont être sélectionnés à long terme pour une meilleure
adaptation à l'environnement).
2/22

BASES MOLÉCULAIRES ET CELLULAIRES DES PATHOLOGIES – Intégration des métabolismes
B. Les sources d'énergie
I. Diversité et complémentarité des sources d’énergie
L’ensemble des réactions participant à la vie d’une cellule utilise comme énergie potentielle la molécule d’ATP.
En 24h, la totalité des cellules de l’organisme a besoin de 124 kg d’ATP (soit deux fois notre masse corporelle
par jour!). L’énergie nécessaire ne peut donc pas être stockée sous cette forme.
Par contre, n’importe quelle cellule possédant des mitochondries peut produire de l'ATP (donc tous les types
cellulaires sauf les érythrocytes), et ceci à partir de différentes sources (oses, acides gras, acides aminés, corps
cétoniques...). Ces différentes sources sont accessibles à partir du sang, de la lymphe ou du LCR.
Tout le problème de la régulation du métabolisme va être d'aboutir à la synthèse d'ATP à partir de ces
différentes sources en un temps compatible avec la vitesse d'utilisation de l'ATP par une cellule donnée (chaque
cellule utilise une quantité différente d'ATP et cela dépend de sa fonction : une cellule musculaire consommera
beaucoup plus d'ATP qu'une cellule pancréatique par exemple).
II. Les différentes sources d'énergie
Energie chimique
potentielle (kJ/mole)
Liaisons riches en
énergie (LRE/mole)
Quantité utilisée en
une journée (g/24h)
Réserve disponible
(g/individu)
ATP 30 1 124000 75
P-Créatine 43 1 37000 65
Glucose 2876 38 471 10
Glycogène (dans le
muscle et dans le
foie)
2876 39 400 400
Triglycérides (source
principale d'énergie)
33515 432 190 7000
On voit bien grâce à ce tableau que l'énergie peut être mise en réserve sous différentes formes. Les triglycérides
représentent la forme de stockage privilégiée. Ces données sont valables en anaérobie.
1. L’ATP peut être formé très rapidement
- À partir d’ADP (adénylate kinase), par tous les tissus.
- À partir de créatine phosphate (créatine-phospho-kinase ou CPK), par tous les tissus mais surtout par
le muscle.
1.
Exemple : Le muscle contient 5mMoles d'ATP et 20mM de créatine phosphate.
La créatine phosphate transfère son énergie à une molécule d’ADP.
Créatine phosphate + ADP → Créatine + ATP
3/22
CPK

BASES MOLÉCULAIRES ET CELLULAIRES DES PATHOLOGIES – Intégration des métabolismes
- Lorsque les réserves en ATP et en phosphate de créatine diminuent, le muscle va faire appel à sa
réserve de glucose (libre, voire glycogène) et va activer une première glycolyse qui est appelée
anaérobie.
2. L’AMP est le meilleur témoin de l’état énergétique de la cellule
- Quand une cellule dépense beaucoup d’énergie elle consomme de l’ATP qu’elle convertit en ADP ou en
AMP.
- L’ADP recèle encore une certaine énergie qu’elle ne peut convertir qu’en ATP grâce à l’enzyme
adénylate kinase.
- Ce système aboutit à un maintien du taux d’ATP mais à une variation importante de la concentration
cellulaire en AMP. L'AMP est en quelque sorte le témoin (« sensor ») du manque d'ATP.
ATP ADP AMP
Repos 1,0 mM 5,0 mM 0,2 mM
Travail 1,5 mM 4,0 mM 0,8 mM
→ Quand on a un besoin d'énergie, ce n'est pas tant la baisse de l'ATP qui va donner le signal qui aboutira à une
compensation, mais c'est le taux d'AMP qui sera un senseur (une sorte de thermostat) et qui donnera le signal du
manque d'énergie, aboutissant à des mécanismes de compensation.
Les régulations font ainsi souvent appel à l'AMP.
3. La glycolyse anaérobie
Cette phase anaérobie est réalisée dans le cytosol et se termine en lactate.
Au pH du cytosol, la lactate déshydrogénase (LDH) fonctionne dans le sens de la production de lactate, jamais
en sens inverse.
La LDH utilise donc le NAD réduit et régénère du NAD oxydé qui est utilisé dans une étape antérieure de la
glycolyse anaérobie.
Le bilan énergétique est faible : elle convertit 1 mole glucose en 2 moles de lactate et 2 molécules d'ATP.
Au total, elle fournit au système musculaire, assez d'énergie pour 40 secondes d’effort intense sans oxygène soit
200m en sprint ou 50m en nageant.
Cette glycolyse anaérobie n'est donc pas un moyen de production d'énergie à long terme.
Le cycle alanine/glucose/lactate
Les acides aminés provenant soit des aliments, soit de la dégradation des protéines musculaires peuvent
alimenter la néoglucogenèse.
4/22

BASES MOLÉCULAIRES ET CELLULAIRES DES PATHOLOGIES – Intégration des métabolismes
Ce cycle dit « cycle des Cori » du nom de leurs découvreurs, permet de maintenir un taux suffisant de glucose
dans le sang même en cas de forte consommation musculaire.
Dans le muscle, on est en anaérobie. Le pyruvate y est donc produit en excès. Celui-ci va, soit former du
lactate, soit former de l'alanine. Ces deux produits passant facilement dans le sang, ils vont rejoindre le foie où
il va y avoir la réaction inverse c'est-à-dire formation de pyruvate. On a une inversion de fonction de la LDH.
De plus, puisqu'on est au niveau du foie, il va y avoir néoglucogenèse et le glucose ainsi produit va repasser
dans le muscle et lui fournir de l'énergie et se transformer en pyruvate. Ce cycle est le cycle de Cori ou cycle
alanine/glucose/lactate.
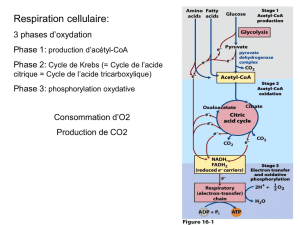
4. La source principale d’ATP est mitochondriale
- Dans la membrane interne de la mitochondrie , le complexe de l’ATP synthase forme de l’ATP à partir
d’ADP en utilisant le gradient de pH entre la matrice et l’espace intermembranaire.
- Ce gradient est le résultat du fonctionnement de la chaîne respiratoire. Ce sont les dinucléotides réduits
(NADH et FADH) qui apportent à la fois les protons et les électrons. Ceux-ci se combineront avec une
molécule de dioxygène pour donner deux molécules d'eau.
- Les dinucléotides réduits proviennent principalement du fonctionnement du cycle de Krebs.
- Celui-ci est initié par la condensation d'une molécule d'acétyl-coA avec une molécule d'oxalo-acétate
dans la matrice mitochondriale pour former du citrate.
III.L’acétyl-coA mitochondrial
C’est le carrefour de convergence des 2 sources principales de réserve d’énergie :
1. Il permet la glycolyse aérobie :
Le pyruvate n’est pas converti en lactate mais traverse la double membrane mitochondriale où il est utilisé par
le complexe de la pyruvate déshydrogénase pour former l’Acétyl-coA.
2. Il achève la dégradation des acyl-coAs :
Les acides gras sont convertis en acyl-coA dans le cytosol.
5/22
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%