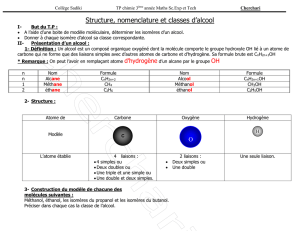
Chapitre 2 L`atome d`hydrogène isolé

7
Chapitre 2
L’atome d’hydrogène isolé
Notations:
qe= 1.60217733 (49) 10−19 C: charge de l’électron
qp=−qe(à 10−21 près) : charge du proton
me= 9.10953 (5) 10−31 kg : masse de l’électron
Mp= 1.67495 (1) 10−27 kg : masse du proton
Pour alléger les expressions, on introduira
e2=q2
e
4π²0
µH=meMp
me+Mp: Masse réduite de l’hydrogène.
Enfin, on définit
a0=¯h2
mee2= 52.9177249 (24) pm : rayon de Bohr de H
α=e2
¯hc = 1/137.0359895 (61) : constante de structure fine
2.1 Rappels: l’atome d’hydrogène non relativiste
L’atome d’hydrogène "non relativiste" est constitué d’un proton et d’un électron en inter-
action coulombienne. Par extension, le traitement pourra s’appliquer à n’importe quel système
de deux particules chargées (de signe opposé) en interaction (deutérium, tritium, ions hydro-
génoïdes, antihydrogène (¯pe+1996), positronium (e+e−1951), muonium (µ+e−1960), hydro-
gène muonique (pµ−) ...).
Après séparation des parties correspondant au mouvement d’ensemble de l’atome, du mou-
vement relatif dans le centre de masse, on obtient le hamiltonien correspondant au mouvement
dans le centre de masse de la particule relative:
H0=P2
2µ+V(r)(2.1)

8
CHAPITRE 2. L’ATOME D’HYDROGÈNE ISOLÉ
qui est constitué du terme d’énergie cinétique (on a introduit ici µla masse réduite d’un système
hydrogénoïde quelconque) et du terme d’énergie potentielle coulombienne:
V(r) = −Zq2
4π²0r=−Ze2
r(2.2)
Le Hamiltonien (2.1) peut être réécrit à l’aide de l’opérateur L2(carré du moment cinétique):
H0=−¯h2
2µr
∂2
∂r2r+1
2µr2L2+V(r)(2.3)
H0commute avec toutes les composantes du moment cinétique orbital Liet donc en particulier
avec L2et Lzavec lesquels il forme un ensemble d’opérateurs qui commutent. On peut donc
trouver une base d’états propres communs à H0,L2et Lz. Ceux-ci s’écrivent:
hr,θ,φ|n,l,mli=ψn,l,ml(r,θ,φ) = Rn,l(r)Yml
l(θ,φ)(2.4)
où Rn,l(r)et Yml
l(θ,φ)constituent la partie radiale et la partie angulaire de la fonction d’onde
respectivement. On rappelle que les harmoniques sphériques sont états propres de L2et Lzavec
les valeurs propres ¯h2l(l+ 1) et ¯hmlrespectivement :
L2Yml
l(θ,φ)=¯h2l(l+ 1)Yml
l(θ,φ)(2.5a)
LzYml
l(θ,φ)=¯hmlYml
l(θ,φ)(2.5b)
Les nombres quantiques n,l,mlsont :
n= 1,2,3... : nombre quantique principal
l= 0,1,...(n−1) : nombre quantique orbital
−l≤ml≤l:mlnombre quantique magnétique
Les valeurs propres de H0ne dépendent que de net sont données par
En=−Z2EI
n2(2.6)
Ces états sont dégénérés n2fois. EIest l’énergie d’ionisation du niveau fondamental de H:
EI=µe4
2¯h2=µ
me
e2
2a0
=µ
m2
e
¯h2
2a2
0
=1
2µc2α2(2.7)
On définit la constante de Rydberg par
R∞=me
e4
2¯h2= 109737.3156852 (8)cm−1(2.8)
On a donc EI=RH=µ
meR∞= 13.59 eV
Les états atomiques sont repérés par la valeur de net une lettre associée à l, en adoptant la
convention :
l=0 1 2 3 4 ...
noté s p d f g ...

2.1. RAPPELS: L’ATOME D’HYDROGÈNE NON RELATIVISTE
9
On obtient ainsi les orbitales atomiques 1s; 2s, 2p; 3s, 3p, 3d ...
Les fonctions d’onde des premiers niveaux d’énergie sont données dans les tableaux sui-
vants.
Harmoniques sphériques
l m Y ml
l(θ,φ)Yml
l(x,y,z)
0 0 q1/4πq1/4π
1 0 q3/4πcos θq3/4π z/r
1 1 −q3/8πsin θ eiφ −q3/8π(x+iy)/r
2 0 q5/4π³3
2cos2θ−1
2´1
2q5/4π(2z2−x2−y2)/r2
2 1 −q15/8πsin θcos θ eiφ −q15/8π(x+iy)z/r2
2 2 q15/32πsin2θ e2iφ q15/32π(x+iy)2/r2
avec Y−ml
l(θ,φ) = (−1)mlYml
l(θ,φ)∗(complexe conjugué)
Fonctions radiales et densité radiale de probabilité
n l Fonction Rn,l(r) Densit´e de probabilit´e u2
n,l(r) = r2R2
n,l(r)
1 0 2 ³1
a0´3/2exp ³−r
a0´4³1
a0´3r2exp ³−2r
a0´
2 0 2 ³1
2a0´3/2³1−r
2a0´exp ³−r
2a0´4³1
2a0´3r2³1−r
2a0´2exp ³−r
a0´
2 1 q1
3³1
2a0´3/2(r/a0) exp ³−r
2a0´1
3³1
2a0´3³r2
a0´2exp ³−r
a0´
3 0 2 ³1
3a0´3/2³1−2r
3a0+2r2
27a2
0´exp ³−r
3a0´4³1
3a0´3r2³1−2r
3a0+2r2
27a2
0´2exp ³−2r
3a0´
3 1 4√2
9³1
3a0´3/2r
a0³1−r
6a0´exp ³−r
3a0´32
81 ³1
3a0´3³r2
a0´2³1−r
6a0´2exp ³−2r
3a0´
3 2 4
27√10 ³1
3a0´3/2³r
a0´2exp ³−r
3a0´ ³ 4
27 ´21
10 ³1
3a0´3r2³r
a0´4exp ³−2r
3a0´
On peut remarquer que l’expression générale de ces parties radiales est le produit d’une expo-
nentielle décroissante (de "portée" n a0) par un polynôme en r/a0de degré (n−1) et de plus
petit terme en (r/a0)l. On en déduit que le nombre de nœuds de la partie radiale est égal à
(n−l−1). En particulier, cela signifie que les orbitales de lmaximal (l=n−1) ne s’annullent
pas et présentent un maximum unique en r=an=n2a0. Par ailleurs, seules les orbitales s
(l= 0) sont non nulles en r= 0.
Allure des principales orbitales atomiques (cf http://winter.group.shef.ac.uk/orbitron/)

10
CHAPITRE 2. L’ATOME D’HYDROGÈNE ISOLÉ
2.2 Structure fine de l’atome d’hydrogène
2.2.1 Termes supplémentaires au potentiel coulombien
Pour des énergies faibles, l’Hamiltonien d’un électron soumis à un champ électrique dérivé
d’un potentiel central φ(r)peut s’écrire
H=H0+WSF (2.9)
où H0est donné par (cf eq. 2.1)
H0=p2
2me
+V(r)(2.10)
avec V(r) = qeφ(r)(V(r) = −e2/r, pour l’atome d’hydrogène), est l’Hamiltonien d’ordre
zéro non relativiste.
L’opérateur WSF est un terme correctif appelé Hamiltonien de structure fine, qui tient
compte des effets relativistes. On l’écrit sous la forme :
WSF =Wcr +WD+WSO (2.11)
où
Wcr =−p4
8m3
ec2(2.12)
est la correction de cinématique relativiste,
WD=¯h2
8m2
ec2∇2V(r)(2.13)
est appelé terme de Darwin et
WSO =1
2m2
ec2
1
r
dV
dr `.s(2.14)
est le terme spin-orbite avec `le moment cinétique orbital de l’électron et sson spin. Cette
expression de WSF résulte d’un développement limité de l’équation relativiste de Dirac à l’ordre
2 en v2/c2.
Le Hamiltonien de structure fine est écrit avec meet non pas la masse réduite µ. L’expres-
sion exacte écrite en fonction de µest plus complexe et ne s’acarte de la forme donnée ici que
d’une quantité très faible, en me/MP.

2.3. AUTRES CORRECTIONS
11
2.2.2 Règles de sélection de WSF - Mode de calcul des corrections
Comme les niveaux de H0sont dégénérés n2fois si on ne tient pas compte du spin ou 2n2
fois en tenant compte du spin, on va utiliser la théorie des perturbations au 1er ordre pour des
systèmes dégénérés. Pour cela, il faut diagonaliser la restriction de WSF à chacun des sous-
espaces propres Ende H0.
Les sous-espaces Ensont engendrés par tous les états |n,l,mlioù let mlprennent toutes
les valeurs possibles. Tout opérateur commutant avec L2et Lzse trouve donc diagonal dans ce
sous-espace. C’est le cas de Wcr et WDqui ne font intervenir que la variable ret donc n’agissent
que sur la partie radiale. WSO est diagonal dans la base couplée |n,(l,s); j,mji. Comme les
éléments de matrice de Wcr et WDne dépendent que de l, et que le passage de la base découplée
|n,l,ml;s,msià la base couplée s’effectue à l’intérieur d’un sous-espace En,l , ces opérateurs
restent diagonaux dans la base couplée. En conclusion, WSF est diagonal dans la base couplée.
La correction au 1er ordre de la théorie des perturbations pourra donc être effectuée en prenant
directement cette partie diagonale. On va donc maintenant calculer successivement les éléments
de matrice de chacun des termes de WSF .
2.2.3 Calcul des corrections de structure fine pour les niveaux n= 1 et 2
a. Terme de cinématique relativiste
b. Terme de Darwin
c. Terme spin - orbite
2.2.4 Bilan
2.3 Autres corrections
2.3.1 Lambshift
2.3.2 Effet de volume du noyau
2.4 Structure hyperfine de l’atome d’hydrogène
2.4.1 Structure hyperfine dipolaire magnétique
2.4.2 Structure hyperfine quadrupolaire électrique
1
/
5
100%