TS-Cours C09 Groupes et spectres IR

C9 : Groupes caractéristiques
N
N
No
o
om
m
me
e
en
n
nc
c
cl
l
la
a
at
t
tu
u
ur
r
re
e
e
s
s
sy
y
ys
s
st
t
té
é
ém
m
ma
a
at
t
ti
i
iq
q
qu
u
ue
e
e
F
F
Fa
a
am
m
mi
i
il
l
ll
l
le
e
es
s
s
d
d
de
e
e
c
c
co
o
om
m
mp
p
po
o
os
s
sé
é
és
s
s
o
o
or
r
rg
g
ga
a
an
n
ni
i
iq
q
qu
u
ue
e
es
s
s
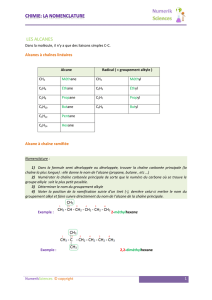
Associer un groupe caractéristique à une fonction dans le cas
des alcools, aldéhydes, cétones, acides carboxyliques, esters,
amines et amides.
Connaître les règles de nomenclature de ces composés ainsi
que celle des alcanes et alcènes.
Utiliser le nom systématique d’une espèce chimique organique
pour en déterminer les groupes caractéristiques et la chaîne
carbonée.
C
C
C
O
O
OM
M
MP
P
PO
O
OS
S
SÉ
É
ÉS
S
S
O
O
OR
R
RG
G
GA
A
AN
N
NI
I
IQ
Q
QU
U
UE
E
ES
S
S
L'étymologie du terme « organique » est historique. La
chimie organique était, au début, la chimie des substances
formées par les organismes vivants (...).
Une caractéristique du carbone consiste en l’aptitude
qu’ont ses atomes à s’enchaîner les uns aux autres, par des
liaisons covalentes, d’une façon presque indéfinie, pour
former des chaînes carbonées d’une grande diversité (...).
Ces enchaînements carbonés constituent le squelette des
composés organiques. Source : Wikipédia
Tout composé contenant au moins l’élément carbone et un
ou plusieurs des éléments suivants : hydrogène,
halogènes, oxygène, soufre, phosphore, silicium ou azote,
à l’exception des oxydes de carbone (CO et CO
2
) et des
carbonates (CO
32-
) et bicarbonates (ou hydrogéno-
carbonate HCO
3–
) inorganiques (c’est-à-dire associé à un
cation inorganique).
Source : directive européenne du 11 mars 1999
N
N
N
O
O
OM
M
ME
E
EN
N
NC
C
CL
L
LA
A
AT
T
TU
U
UR
R
RE
E
E
S
S
SY
Y
YS
S
ST
T
TÉ
É
ÉM
M
MA
A
AT
T
TI
I
IQ
Q
QU
U
UE
E
E
Parce qu’il existe un quantité incalculable de composés
organiques, l’IUPAC (International Union of Pure and
Applied Chemistry) a défini une règle de nomenclature
(attribuation d’un nom) systématique (qui découle d’un
système de règles).
Le nom IUPAC pour un composé organique contient deux
parties :
• Une racine indique combien d’atomes de carbone sont
présents dans la chaîne carbonée ;
Nombre de C Racine
1 méth-
2 éth-
3 prop-
4 but-
5 pent-
6 hex-
7 hept
8 oct
9 non-
10 déc-
• Un préfixe et/ou un suffixe indique la famille à laquelle
il appartient.
Attention : ces règles ont changé au cours du temps,
certains emballages ont toujours une étiquette avec des
noms obéissant à d’anciennes nomenclature. De plus
beaucoup de composés courants possède un « nom usuel »
qui est toujours utilisé.
Tertiobutanol, méthylpropan-2-ol, méthylpropanol-2, tert-
butanol, Alcool tert-butylique, triméthylcarbinol, 2-
méthyl-2-propanol : tous ces noms désigne une seule
molécule :
CH
3
C
CH
3
CH
3
OH
Les composés chimiques d’une même famille (c’est-à-dire
comportant les mêmes groupes fonctionnels) ont des
propriétés chimiques comparables.
A
A
A
L
L
LC
C
CA
A
AN
N
NE
E
ES
S
S
Groupe caractéristique : Aucun. Constitués seulement
de C et de H, sans double ou triple liaison.
Nomenclature :
• Trouver la chaîne carbonée la plus longue. Prendre la
racine correspondante et lui ajouter le suffixe -ane
(méthane, éthane, etc.). Vous avez la racine du nom.
Si la molécule est ramifiée (ce qui sera souvent le cas)
• Ajouter un préfixe indiquant le nombre de carbone de la
ramification (méthyl, éthyl, etc), avec éventuellement le
pré-préfixe di, tri, tétra, penta s’il y a plusieurs
ramification du même type.
• Devant ce préfixe, indiquer la position de chaque
ramification, s’il peut y avoir un doute sur la position de la
ramification. Vous devez choisir le sens de numérotation
de la chaîne carbonée de manière à ce que ces positions
soient les plus petites possibles.
• Classer les préfixes dans l’ordre alphabétique sans tenir
compte d’un éventuel di, tri, tétra, etc : « éthyl » s’écrit
avant « méthyl » (ou « diméthyl » ou triméthyl »), qui lui-
même s’écrit avant « propyl ».
propane méthylpropane 3-méthylpentane
2,3-diméthylpentane 3,3,4-triméthylhexane
3-éthyl-3,4,4,5-tétraméthylheptane
Attention aux virgules et aux tirets !
Si vous savez nommer un alcane, il faudra peu de
choses pour que vous sachiez nommer les autres
composés, car leur nomenclature en dérive.
Réactivité : Rien de spécial. Ils sont assez peu réactifs,
sauf en présence de chaleur et d’un comburant (O
2
) →
Boum
A
A
A
L
L
LC
C
CÈ
È
ÈN
N
NE
E
ES
S
S
Groupe caractéristique : présence d’une double liaison
carbone-carbone.
Nomenclature : remplacer le « -ane » des alcanes par
« -ène », avec position de la double liaison si nécessaire.
La chaîne doit être numérotée de manière à attribuer le
plus petit nombre possible à cette liaison. Attention à la
présence éventuelle d’une isomérie Z ou E.
propène but-1-ène 2-méthylbut-1-ène
Réactivité : due à la double liaison qui peut s’ouvrir pour
fixer d’autres réactifs (réactions d’addition, chapitre C12).
A
A
A
L
L
LC
C
CO
O
OO
O
OL
L
LS
S
S
Groupe caractéristique : –OH (hydroxyle) lié à un
carbone (appelé carbone fonctionnel, car c’est lui qui
porte la « fonction » alcool), qui n’est lui-même lié qu’à
des H et/ou des C par des liaisons simples.
Nomenclature : comme alcane + terminaison en -ol, avec
position du groupe hydroxyle si nécessaire.
Classe d’un alcool (1
ère
S) : si le C fonctionnel est lié à
aucun ou un seul autre carbone, l’alcool est dit primaire. si
le C fonctionnel est lié à deux autres carbone, l’alcool est
dit secondaire. Vous devinez pour « alcool tertiaire » ?
propan-1-ol propan-2-ol méthylpropan-2-ol
OH
OH OH
primaire secondaire tertiaire
Réactivité : complexe et variée
A
A
A
L
L
LD
D
DÉ
É
ÉH
H
HY
Y
YD
D
DE
E
ES
S
S
Groupe caractéristique : C=O (carbonyle) en bout de
chaîne (donc inutile d’indiquer sa position, c’est sans
équivoque).
Nomenclature : comme alcane + terminaison en -al.
O
propanal
C
C
C
É
É
ÉT
T
TO
O
ON
N
NE
E
ES
S
S
Groupe caractéristique : C=O (carbonyle) pas en bout
de chaîne.
Nomenclature : comme alcane + terminaison en -one,
avec position du groupe carbonyle si nécessaire.
O
butanone
O
hexan-2-one
Réactivité : la réactivité des deux familles précédentes
possèdent des similitudes. Elle est complexe et variée.
A
A
A
M
M
MI
I
IN
N
NE
E
ES
S
S
Groupe caractéristique : un atome d’azote lié à des H
et/ou des C (au moins 1, sinon, il s’agit de l’ammoniac
NH
3
) ne possédant que des liaisons simples vers des
atomes de C et/ou de H. Le groupe –NH
2
est appelé
groupe amino.
Nomenclature : Dans le cas des amines primaires
(possèdant un groupe –NH
2
), comme alcane + terminaison
en amine. Indiquez la position du groupe amino si
nécessaire. Si l’amine est secondaire (elle est lié à deux
groupes alkyles (terme général pour désigner les groupes
méthyle, éthyle, etc.), le groupe le plus petit est considéré
comme une ramification sur le N (et portera donc le
« numéro » N). Pareil en cas d’amine tertiaire.
CH
3
NH
2
CH
3
NH CH
3
CH
3
N
CH
3
CH
3
NH
méthanamine
primaire N-méthylméthanamine
secondaire
N,N-diméthylméthanamine
tertiaire N,3-diméthylbutan-2-amine
secondaire
Réactivité : complexe et variée
A
A
A
C
C
CI
I
ID
D
DE
E
ES
S
S
C
C
CA
A
AR
R
RB
B
BO
O
OX
X
XY
Y
YL
L
LI
I
IQ
Q
QU
U
UE
E
ES
S
S
Groupe caractéristique : carboxyle ci-dessous. Il se situe
forcément en bout de chaîne.
C
O
O H
Nomenclature : acide « alcan »-oïque, ou « alcan »
désigne le nom de l’alcane correspondant.
O
OH
O OH
acide éthanoïque acide méthylpropanoïque
Réactivité : Ce sont tous des acides plus ou moins faibles.
Généralement, plus la chaîne carbonée est longue, plus ce
sont des acides faibles (et moins ils sont solubles dans
l’eau).
TS - 2015
www.pichegru.net

E
E
E
S
S
ST
T
TE
E
ER
R
RS
S
S
Groupe caractéristique
C
O
O R
2
R
1
R
1
peut représenter un groupe alkyle ou un H, le groupe
R
2
est forcément un groupe alkyle (méthyle, éthyle, etc.)
Nomenclature : elle est composée de deux parties.
L’acide à l’origine de l’ester et le groupe R
2
venu se
subsituer à l’H de l’acide de départ. Prendre le nom de la
base conjuguée de l’acide de départ (méthanoate,
éthanoate, etc.) et le ajouter « de + nom de l’alkyle.
C
O
OCH
2
H CH
3
C
O
OCH
3
CH
3
méthanoate d'éthyle éthanoate de méthyle
A
A
A
M
M
MI
I
ID
D
DE
E
ES
S
S
Groupe caractéristique
C
O
N
R
2
R
1
R
3
R
1
, R
2
et R
3
peuvent être des H ou des groupes alkyle. R
1
est considéré comme le squelette de la molécule, R
2
et R
3
,
si ce sont des groupes alkyles, sont considérés comme des
ramification.
Nomenclature : le groupe fonctionnel est forcément en
bout de chaîne. Prendre le nom de l’alcane et ajouter le
suffixe « amide ». En cas d’amides secondaires ou
tertiaires, faire apparaître le préfixe (méthyl, éthyl)
précéde de la lettre N pour montrer qu’il est lié à l’azote.
O
NH
2
O
NH
O
N
méthanamide
N-méthyléthanamide N,N-diméthyléthanamide
Règles complètes de l’IUPAC
S
S
Sp
p
pe
e
ec
c
ct
t
tr
r
ro
o
os
s
sc
c
co
o
op
p
pi
i
ie
e
e
i
i
in
n
nf
f
fr
r
ra
a
ar
r
ro
o
ou
u
ug
g
ge
e
e
Exploiter un spectre IR pour déterminer des groupes caractéristiques à l’aide de tables de données ou de logiciels, dans le cas des
alcools, aldéhydes, cétones, acides carboxyliques, esters, amines et amides.
V
V
V
I
I
IB
B
BR
R
RA
A
AT
T
TI
I
IO
O
ON
N
N
D
D
DE
E
ES
S
S
L
L
LI
I
IA
A
AI
I
IS
S
SO
O
ON
N
NS
S
S
C
C
CO
O
OV
V
VA
A
AL
L
LE
E
EN
N
NT
T
TE
E
ES
S
S
Les liaisons covalentes peuvent être visualisées comme de minuscules ressorts liant deux atomes. Elles peuvent vibrer
en élongation ou en déformation. Comme pour l’électron en orbite autour d’un atome, l’énergie de vibration de ces
liaisons est quantifié. Si l’on envoie sur une liaison un photon ayant l’énergie adéquate (c’est-à-dire l’énergie
correspondant à la différence entre deux niveaux d’énergie de vibration), la liaison pourra l’absorber et vibrer avec une
plus grande amplitude.
Ces niveaux d’énergies dépendent du type d’atomes (ou groupe d’atome) liés.
S
S
S
P
P
PE
E
EC
C
CT
T
TR
R
RE
E
ES
S
S
I
I
IN
N
NF
F
FR
R
RA
A
AR
R
RO
O
OU
U
UG
G
GE
E
E
Le spectre infrarouge d’une molécule est le tracé de la transmittance T (en %) en fonction du nombre d’onde
σ
(cm
-1
)
σ
= 1/
λ
, avec
λ
en cm
Ce spectre, très complexe, est caractéristique d’une molécule. Il est possible de l’analyser en partie pour en déduire les
groupes présents dans une molécule et ainsi avoir une idée de sa composition.
Spectre du pentan-2-ol
Un spectre s’analyse à l’aide d’un tableau résumant les nombres d’onde d’absorption des différents groupes (cf. rabat
de couverture final de votre livre).
La partie appelée « empreinte digitale » est propre à la molécule.
Dans ce spectre, on peut voir les liaisons O-H (alcool lié) et les liaisons C-H (alcane)
T (%)
100
50
0
4000 3000 2000 1500 1000 500
Vibrations d’élongations « Empreinte digitale »
O-H liée C-H alcane
σ
(cm
-
1
)
1
/
2
100%