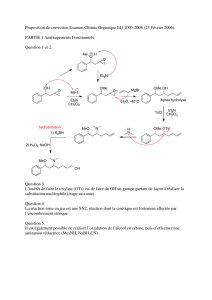
L`invention a pour objet des oligosaccharides cycliques, notamment

1
L’invention a pour objet des oligosaccharides cycliques,
notamment dérivés de cyclodextrines (en abréviation CDs) et plus
particulièrement de cyclodextrines (CDs) amphiphiles.
Elle vise également un procédé de préparation de ces
oligosaccharides cycliques ainsi que leurs applications dans les mêmes
domaines que les cyclodextrines (CDs) et leurs dérivés déjà connus.
5
10
15
20
Elle concerne notamment des dérivés amphiphiles de
cyclodextrines (CDs) bis aminées présentant des propriétés d’auto-
organisation en milieu aqueux et/ou étant susceptibles de s’incorporer dans
des systèmes organisés conduisant à la formation de systèmes mixtes.
Les cyclodextrines sont des oligosaccharides cycliques non
réducteurs, obtenues industriellement par la dégradation enzymatique de
l’amylose (forme linéaire de l’amidon) à l’aide d’une enzyme, la cyclodextrine
glucosyltransférase (CGTase), d’origine bactérienne (Bacillus Macerans,
Alkalophylic bacillus,…).
Les trois CDs les plus fréquemment rencontrées sont l’α-, la β-
et la γ-CD constituées respectivement de 6, 7 et 8 sous unités D-
glucopyranosiques, liées entre elles par des liaisons glycosidiques α(1t4), tel
que montré au schéma 1 :
Schéma 1

2
Il existe des CDs de plus grande taille, telles que la δ-CD, a ε-
CD respectivement constituées de 9 et 10 unités, et de taille plus petite,
comme la cyclo-α(1t4)-glucopentaoside à 5 unités, qui ont été isolées ou
totalement synthétisées.
Différentes nomenclatures sont utilisées dans la littérature pour
l’appellation des CDs : β-dextrin de Shardinger, cyclomaltoheptaose,
cycloheptaglucan, cycloheptaamylose, β-CD, BCD, C7A.
5
10
15
20
25
Les CDs ont une structure tridimensionnelle en forme de
cylindre cônique dont la paroi est constituée par les unités glucoses, en
conformation chaise 4C1, tel que montré au schéma 2 :
Schéma 2
Les hydroxyles secondaires (OH-2, OH-3) sont situés sur le
côté le plus grand du tronc cônique alors que les hydroxyles primaires (OH-6)
sont localisés sur le petit côté. La présence de ces groupements hydroxyles sur
les bords de la couronne confère à la partie extérieure de la CD un caractère
hydrophile (surface en contact avec le solvant), alors que l’intérieur de la
cavité, tapissée d’atomes d’hydrogène (H-3, H-5, H-6) et de l’oxygène inter-
glycosidique (O-4), est hydrophobe.
La structure des CDs est stabilisée par une véritable ceinture
de liaisons hydrogènes inter-résidus entre les OH-2 d’une unité glucose et les
OH-3 de l’unité voisine. Dans le cas de la β-CD, cette ceinture de liaisons par
pont à hydrogène rend sa structure très rigide et peut justifier de sa faible
solubilité dans l’eau par rapport aux autres CDs.

3
En solution aqueuse, la cavité apolaire de la CD est occupée
par des molécules d’eau, ce qui est énergétiquement défavorable (interactions
polaire–apolaire). Ces molécules d’eau pourront donc être facilement
substituées par une “molécule invitée” appropriée, moins polaire que l’eau.
Il existe bien souvent des différences entre les propriétés
physico-chimiques des complexes d’inclusion, ou clathrate, et celles des
molécules invitées libres et les CDs libres. Ainsi, et notamment par rapport aux
molécules libres, on observe en général une augmentation de la solubilité dans
l’eau, une diminution de la diffusion et de la volatilité, une modification des
propriétés spectrales et bien souvent des variations de la réactivité.
5
10
15
20
25
30
C’est cette propriété remarquable qu’ont les CDs de complexer
en milieu aqueux un panel impressionnant de molécules hôtes qui fait que l’on
trouve dans la littérature de nombreux domaines d’application dans la
formulation de composés actifs.
Dans l’industrie, les propriétés des CDs sont largement
exploitées dans le milieu pharmaceutique. On peut citer, par exemple,
l’utilisation de CDs dans des formulations de diclofénac de sodium, tel que
décrites dans les documents US 4,829,088 et US 4,960,799, pour garantir la
solubilité du composé actif, ou encore dans une formulation anti-inflammatoire,
telle que décrite dans le document US 6,667,056.
Les principales CDs utilisées à l’heure actuelle par l’industrie
pharmaceutique sont des β-CD normales ou modifiées. On trouve néanmoins
quelques exemples avec l’α-CD et la γ-CD.
La plupart des médicaments à base de CDs est administrée
par voie orale (tablettes, dragées, sirops,…), cependant, il y a lieu de
remarquer que toutes les spécialités administrées par voie nasale ou oculaire
utilisent de CDs modifiées (Me-β-CD, hydroxypropyl-β-CD) qui mettent à profit
des mécanismes de passage transmembranaire. Ce mécanisme est sans
doute facilité par le caractère amphiphile que confèrent les groupements
alkyles greffés sur les CDs employées.

4
Le marché des CDs est mondial et les entreprises
pharmaceutiques qui commercialisent ces produits sont essentiellement
européennes, américaines, japonaises et sud-américaines. Beaucoup de ces
médicaments sont utilisés comme anti-inflammatoires, tels que, par exemple,
l’anti-inflammatoire connu sous le nom commercial de Piroxicam, mais on
trouve d’autres applications.
5
10
15
20
25
30
Il existe également beaucoup d’applications dans les domaines
de l’agroalimentaire, de la cosmétique, des détergents et aussi du textile.
Actuellement, les applications des CDs dans la formulation des
pesticides restent encore modestes car l’industrie des pesticides est très
sensible au prix des matières premières, toutefois, une baisse des coûts de
production de la β-CD pourrait rapidement changer la donne dans ce secteur
d’activité.
Les applications industrielles faisant appel aux CDs
représentent un marché en plein essor.
Dans les domaines plus fondamentaux et technologiques, les
CDs trouvent aussi de nombreuses applications, comme en chimie analytique,
grâce à leur potentiel pour la séparation chirale (HPLC, Electrophorèse
Capillaire) ou en catalyse dans la conception d’enzymes artificiels.
Depuis plusieurs années, une attention particulière a été portée
sur l’utilisation de cyclodextrines modifiées pour le ciblage des médicaments.
Le principe consiste à greffer sur la cyclodextrine une ou plusieurs antennes
destinées à assurer une fonction de vectorisation vers un site d’action
privilégié, la CD jouant le rôle de véhicule moléculaire pour le principe actif.
Différentes approches ont été envisagées dans le choix du vecteur. Celui-ci
peut avoir un mode de reconnaissance spécifique pour des récepteurs
membranaires (antennes poly saccharidiques ou peptidiques) ou non
spécifique, privilégiant le passage transmembranaire et destiné à des
applications topiques (antennes de type lipidique).
Il existe plusieurs familles de CDs amphiphiles selon la position
et le nombre de groupements hydrophobes portés par la CD, on distingue ainsi

5
la persubstitution sur la face primaire (en 6) (CD “médusa-like”), la
persubstitution sur la face secondaire (en 2 et 3) (CD “skirt-shaped”), la
persubstitution sur toutes les positions (2, 3 et 6) et enfin la monosubstitution
sur un des hydroxyles de la face primaire.
Les cyclodextrines persubstituées sur la face primaire,
secondaire, ou bien sur les deux côtés ne sont en général pas solubles dans
l’eau. Elles ne s’organisent pas de manière spontanée. Les deux types de
systèmes organisés obtenus à partir de ces composés sont des films de
Langmuir-Blodgett (monocouches ou multicouches) insolubles à l’interface
air/eau et des nanoparticules. Ces systèmes sont hétérogènes. De plus
l’effondrement des chaînes sur elles-mêmes rend la cavité de ces CDs
inaccessible à toute molécule invitée.
5
10
15
20
25
influence ainsi de manière considérable leurs propriétés physico-chimiques,
notamment la solubilité dans l’eau et le type d’organisation.
Contrairement aux dérivés persubstitués, les CDs
monosubstituées sont souvent solubles en milieu aqueux, dans lequel elles
peuvent s’organiser spontanément. Ainsi par exemple il est connu qu’il y a
formation de micelles avec la Chol-DIMEB (« Cholesteryl-Dimethyl-Beta-
Cyclodextrin ») représentée sur le schéma 3 :
Schéma 3
Le faible degré de substitution et la solubilité dans l’eau
permettent à la cavité de ces molécules d’être très accessibles aux molécules
organiques pour former des complexes d’inclusion.
Il semble que la Balance Hydrophile-Lipophile (BHL) des CDs
modifiées soit une cause importante de leur caractère amphiphile et qu’elle
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%