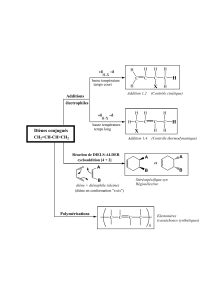
Alcènes et alcynes : Additions sur systèmes conjugués

Complément - Chapitre 7
Alcènes et alcynes
Réactions d’addition sur des systèmes conjugués (addition électrophile
et cycloaddition de Diels-Alder sur les diènes conjugués)
Puisque le phénomène de résonance est possible dans les systèmes conjugués, une
attention particulière doit être apportée à ce genre de structure lors des réactions
chimiques.
- Addition électrophile sur les diènes conjugués
Les réactions d’addition sur les diènes conjugués donnent lieu à un résultat quelque peu
étonnant. En effet, quand une mole de bromure d’hydrogène est additionnée à une mole
de buta-1,3-diène, deux produits sont obtenus (voir la figure 7.a).
Figure 7.a Réaction globale de l’addition d’un halogénure d’hydrogène sur un diène
conjugué
CH2CH CH CH2
buta-1,3-diène
HBr
Br
Br
CH2CH CH CH2
CH2CH CH CH2
H
H
3-bromobut-1-ène
1- -2-ène
(Addition-1,2)
(Addition-1,4)
b
r
o
m
o
b
u
t
Au cours d’une addition-1,2, le réactif est additionné au premier et au deuxième atome de
carbone d’un diène conjugué, tandis que pour l’addition-1,4, l’addition se réalise sur le
premier et le quatrième carbone ; une liaison double apparaît entre les carbones 2 et 3.
La formation du 3-bromobut-1-ène implique que le HBr s’est additionné à l’une des deux
liaisons doubles, sans toucher à la seconde. Ce produit résulte d’une addition-1,2. La
formation du 1-bromobut-2-ène peut paraître inattendue. L’hydrogène et le brome se sont
ajoutés au carbone-1 et au carbone-4 du diène de départ, mais une nouvelle liaison double
est apparue entre le carbone-2 et le carbone-3. Ce phénomène, appelé addition-1,4, se
rencontre couramment avec les additions électrophiles sur les diènes conjugués.
Comment peut-on l’expliquer ?
Au cours de la première étape, l’atome d’hydrogène s’additionne à l’atome de carbone
terminal de l’une des liaisons doubles selon la règle de Markovnikov (voir la figure 7.b).
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 1

Figure 7.b Première étape du mécanisme réactionnel :
attaque du diène sur l’halogénure d’hydrogène
CH2CH CH CH2
buta-1,3-diène
HBr
+CH2CH CH CH2
H
+
1234
Le carbocation qui en découle est stabilisé par résonance. Il s’agit de l’hybride de
résonance des deux formes limites de résonance présentées à la figure 7.c.
Figure 7.c Formes limites de résonance du carbocation
CH2CH CH CH2
H
+CH2CH CH CH2
H
+
La charge positive est donc délocalisée sur le carbone 2 et le carbone 4. Au cours de
l’étape suivante, le carbocation réagit avec l’ion bromure (le nucléophile), soit sur le
carbone 2 pour aboutir au produit de l’addition-1,2, soit sur le carbone 4 pour former le
produit de l’addition-1,4 (voir la figure 7.d).
Figure 7.d Deuxième étape du mécanisme réactionnel : deux additions possibles
de l’ion halogénure menant aux additions-1,2 et -1,4
CH2CH CH CH2
H
+
CH2CH CH CH2
H
+
Br_
Br
Br
Br_
CH2CH CH CH2
CH2CH CH CH2
H
H
+
et
L’addition-1,2 est un produit à contrôle cinétique. Il est plus rapide à former et
majoritaire lorsque la réaction est réalisée à basse température. Par opposition,
l’addition-1,4 est un produit à contrôle thermodynamique et s’avère être plus stable
que celui de l’addition-1,2 puisque l’alcène résultant est plus substitué, c’est-à-dire qu’il
y a plus de substituants, autres que des atomes d’hydrogène, sur les carbones de la liaison
double (on respecte ici la règle de Saytzev, voir la section 9.3.1). Le produit d’une
addition-1,4 sera majoritaire lorsque la réaction se déroule à haute température.
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 2

Exercice 7.a
Expliquez pourquoi, pendant la première étape de la réaction présentée à la figure 7.b, le
proton s’additionne sur le C-1 et non sur le C-2.
Dans un cation allylique, la liaison double carbone–carbone est adjacente à l’atome de
carbone positivement chargé.
Le carbocation intermédiaire de ce genre de réaction, muni d’une liaison double carbone–
carbone adjacente à l’atome de carbone positivement chargé, est appelé cation allylique.
Le cation allylique parent, illustré ci-dessous sous la forme d’un hybride de résonance, est
un carbocation primaire. Cependant, il est plus stable qu’un cation primaire ordinaire
(comme, par exemple, le cation propyle) car sa charge positive est délocalisée entre les
deux atomes de carbone terminaux, comme le montre la carte du potentiel électrostatique
accompagnant la figure 7.e.
Figure 7.e Formes limites de résonance d’un cation allylique et carte de potentiel
électrostatique de son hybride de résonance
HH
H
H
H
+HH
H
H
H
+
Exercice 7.b
Dessinez les formes limites de résonance qui contribuent à l’hybride de résonance du
cation cyclopentén-3-yle.
+
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 3

Exercice 7.c
Écrivez l’équation des produits escomptés de l’addition-1,2 et de l’addition-1,4 du brome
(Br2) sur le buta-1,3-diène.
Cycloaddition sur les diènes conjugués : réaction de Diels-Alder
Les diènes conjugués subissent un autre type d’addition-1,4 lorsqu’ils réagissent avec les
alcènes (ou les alcynes). L’exemple le plus simple est l’addition d’éthylène sur le buta-
1,3-diène qui donne naissance au cyclohexène (voir la figure 7.f).
Figure 7.f Mécanisme général d’une réaction de Diels-Alder
HC CH2
CH2
HC CH2
CH2
HC
HC CH2
CH2
CH2
CH2
Nouvelle liaison σ
Nouvelle liaison πNouvelle liaison σ
buta-1,3-diène éthylène cyclohexène
Ren
d
e
m
ent : 20%
200oC
+
Cette réaction est un exemple de cycloaddition, soit une addition qui aboutit à un produit
cyclique. Cette cycloaddition, qui transforme trois liens π en deux liens σ et un nouveau
lien π, est appelée réaction de Diels-Alder, d’après les deux chercheurs allemands qui
l’ont mise au point, Otto Paul Hermann Diels (1876-1954) et son étudiant Kurt Alder
(1902-1958). La grande utilité de cette réaction pour fabriquer des composés cycliques a
valu à ces chercheurs le prix Nobel de chimie en 1950. Comme pour l’hydroboration,
cette réaction s’effectue selon un mécanisme concerté. En effet, la rupture et la
formation des liaisons se font simultanément.
Les deux réactifs sont constitués d’un diène et d’un diénophile (qui aime les diènes). La
réaction présentée à la figure 7.f n’est pas typique de la plupart des réactions de Diels-
Alder parce qu’elle nécessite une forte température (200 °C) et ne se solde pas par un bon
rendement (20 %). Ce type de réaction donne un excellent rendement à des températures
modérées si le diénophile porte des groupes électroattracteurs1, comme on peut
l’observer à la figure 7.g.
La réaction de Diels-Alder est une cycloaddition mettant en jeu un diène conjugué et
un diénophile et qui aboutit à un produit cyclique dans lequel deux liens σ et un nouveau
lien π sont formés simultanément au bris de trois liens π.
1 Les groupes électroattracteurs sont des groupes d’atomes qui attirent les électrons du lien π, ce qui
appauvrit l’alcène de ses électrons et le rend donc plus électrophile vis-à-vis du diène.
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 4

Figure 7.g Réactions de Diels-Alder impliquant des groupements électroattracteurs
sur le diénophile
O
H
+
H
O
30oC
NC CN
NC CN
+0oC
CN
CN
CN
CN
Remarque : Les réactions de Diels-Alder peuvent donner plusieurs produits possibles et
sont régiosélectives lorsque les diènes et les diénophiles ne sont pas symétriques. Ces
réactions sont alors nettement plus complexes et ne sont pas au programme du cours de
chimie organique au niveau collégial.
Exemple 7.a
Comment une réaction de Diels-Alder pourrait-elle permettre la synthèse du composé
suivant ? O
Solution
Travaillons dans le sens inverse. La liaison double du produit obtenu était auparavant une
liaison simple entre les deux liaisons doubles du diène conjugué de départ. Par
conséquent,
O
+
O
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 5
 6
6
 7
7
 8
8
1
/
8
100%