N europeptidergie - iPubli

6:
p.
N europep tidergie
,
1
o,
1

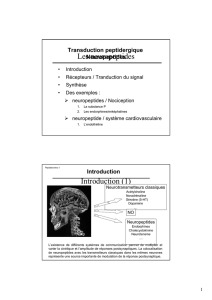
Figure 1.
s
(
)
Bernard Calvino
Jean-Paul Rivot
Marc Peschanski
1
/
2
100%