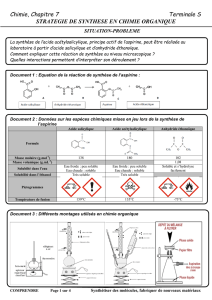
T.P. 14. SYNTHESE DE L`ASPIRINE I. REALISATION

Thème 3: AGIR–Défis du XX
ème
siècle. Synthèse de molécules organiques. Ch.19. Synthèse en chimie organique. Activité expérimentale.
T.P. 14. SYNTHESE DE L’ASPIRINE
Compétence exigible
•
Pratiquer une démarche expérimentale pour synthétiser une molécule organique d’intérêt biologique à partir d’un protocole.
au baccalauréat :
•
Justifier le choix des techniques de synthèse et d’analyse utilisées
•
Effectuer une analyse critique et comparative de protocoles expérimentaux.
I. REALISATION EXPERIMENTALE
L'aspirine (acide acétylsalicylique) est connue pour ses propriétés
antalgiques.
Elle est synthétisée ici à l'aide du protocole ci-contre.
Question 1 : Nommer les groupes caractéristiques présents dans les
réactifs.
Identifier ceux qui réagissent. Quelles sont les fonctions créées ?
Donner le nom du 2
ème
produit.
Document 1 : Le protocole.
1. Synthèse de l'aspirine.
Dans un erlenmeyer de 100 mL bien sec, introduire 5,0 g d'acide salicylique et 7,0 mL d'anhydride éthanoïque mesurés à la
pipette graduée. Ajouter avec précaution 2 gouttes d'acide sulfurique concentré. (Légender la figure ci-contre).
Placer le ballon dans un bain-marie et adapter un réfrigérant à eau. Chauffer pendant 15 minutes à 65 °C.
Retirer le bain-marie et le réfrigérant.
Verser 20 mL d'eau froide en prenant garde aux vapeurs chaudes d'acide.
Placer l’erlenmeyer dans un mélange eau-glace. Lorsque l’erlenmeyer est froid, rajouter petit à petit 70 mL d'eau froide ;
l'aspirine cristallise. La cristallisation prend quelques minutes.
Filtrer les cristaux sur Büchner. Couper l'aspiration, laver avec de l'eau distillée. Rétablir l'aspiration pour retirer l'eau.
Placer les cristaux à l'étuve à 80 °C pendant 20 minutes environ, puis mettre de côté un peu du solide afin de réaliser une
CCM.
2. Recristallisation et analyse de l'aspirine
Recristalliser les cristaux obtenus dans 5 mL d'éthanol. Ajouter alors 20 mL d'eau chaude pour dissoudre les impuretés.
Laisser refroidir au bain-marie glacé : ne pas agiter : l’aspirine recristallise.
Peser les cristaux obtenus et calculer le rendement correspondant avec pour éluant un mélange pentane/acide acétique 80/20.
Réaliser une CCM comportant quatre dépôts différents,
* l'acide salicylique,
* l'aspirine avant purification,
* l'aspirine après purification
* un échantillon d'aspirine commerciale,
Révéler à l'aide d'une lampe UV.
Document 3 : Fiches de sécurité :
Document 2
: Solubilité dans l
’
eau
et dans l’éthanol
de certains composés
:
Acide acétylsalicylique Acide acétique Acide salicylique
Solubilité dans l'eau froide Très peu soluble
Solubilité de l’aspirine dans l’eau à 25°C : 3,3
g.L
-1
(peu soluble) Très soluble Peu soluble
Solubilité dans l’éthanol Solubilité de l’aspirine dans l’éthanol à 25°C : 200 g.L
-
1
(soluble)

Thème 3: AGIR–Défis du XX
ème
siècle. Synthèse de molécules organiques. Ch.19. Synthèse en chimie organique. Activité expérimentale.
Question 2 :
• Analyser le protocole proposé et préciser quelles étapes conduisent à la synthèse de l’aspirine purifiée.
Question 3 : Synthèse
• Pourquoi l’erlenmeyer utilisé doit être bien sec ?
• A quoi sert l’acide sulfurique ajouté en petite quantité ?
• Quelles méthodes sont mis en œuvre pour augmenter la vitesse de la réaction ?
• Montrer que l'un des réactifs est en excès. Déterminer alors les espèces présentes dans l’erlenmeyer en fin de réaction.
• Expliquer pourquoi il est intéressant d'ajouter de l'eau en fin de réaction ?
Question 4 : Séparation :
• Quel est l’avantage d’une filtration sur Büchner par rapport à une filtration simple ?
• Pourquoi rince-t-on le solide ?
• Pourquoi utilise-t-on de l’eau glacée ?
Question 5 : Purification
• Lors de la recristallisation : a. Pourquoi chauffe-t-on ? b. Pourquoi met-on le minimum de solvant de recristallisation ?
• Pourquoi laisse-ton refroidir à température ambiante avant de refroidir dans un bain de glace ?
• Comment choisit-on un solvant de recristallisation ?
Question 6 : Caractérisation :
• Citer les précautions expérimentales à prendre pour réaliser une CCM.
• Reproduire le chromatogramme
• Analyser les résultats de la CCM en attribuant chacune des taches observées.
• L'étape de purification par recristallisation est-elle utile ?
• Proposer une autre méthode de caractérisation qui pourrait être mise en jeu ici.
Question 7 : Rendement :
• Déterminer la masse d’aspirine théorique que l’on peut obtenir si le rendement était de 100 %.
• On obtient une masse d’aspirine après recristallisation de ...... . Déterminer le rendement de la synthèse.
Document 4 : Spectre RMN du produit obtenu :
Question 8 :
• Montrer qu'il s'agit bien de la molécule d'acide acétylsalicylique.
II. ANALYSE D'UN AUTRE PROTOCOLE DE SYNTHESE
Une autre synthèse de l'aspirine utilise également l'acide salicylique (3,0 g) mais remplace l'anhydride éthanoïque par du chlorure d'éthanoyle (2,0 g).
Le solvant est alors le dichlorométhane (85 mL) et la température doit être maintenue à 0 °C. De plus, une base, la triéthylamine (4,0 g), doit être ajoutée.
La verrerie doit être très sèche, et une circulation de gaz inerte comme le diazote permet d'éviter le contact avec l'air.
Question 9 :
• Rechercher les pictogrammes et les phrases de sécurité de chacun des produits engagés.
• Pourquoi faut-il à la fois que la verrerie soit très sèche et que le milieu réactionnel ne soit pas au contact de l'air ?
• Rechercher les prix de l'anhydride éthanoïque et du chlorure d'éthanoyle. Conclure sur le coût et la sécurité de chacune des synthèses.

Thème 3: AGIR–Défis du XX
ème
siècle. Synthèse de molécules organiques. Ch.19. Synthèse en chimie organique. Activité expérimentale.
Pictogrammes de sécurité. Pictogrammes de sécurité. Pictogrammes de sécurité.

Thème 3: AGIR–Défis du XX
ème
siècle. Synthèse de molécules organiques. Ch.19. Synthèse en chimie organique. Activité expérimentale.
Dans la synthèse de l’aspirine, le groupe hydroxyle réagit avec l’anhydride d’acide. La fonction créée est une fonction ester.
Une réaction est sélective lorsque, parmi plusieurs fonctions d’une même molécule, l’une d’elles réagit préférentiellement avec le
réactif considéré. Ce réactif est dit chimiosélectif. Dans l’exemple du paracétamol, les groupes amine et hydroxyle sont
susceptibles de réagir avec l’anhydride acétique et seul le groupe amine réagit.
Il est important que les réactifs introduits ne soient pas détruits par des réactions parasites.
L'acide sulfurique n'apparaît pas dans l'équation de la réaction.
L'anhydride éthanoïque réagit au contact de l'eau pour donner deux molécules d'acide acétique.
L'air contient de l'eau.
Comment exploiter un protocole de synthèse ?
Un protocole basé sur la réaction suivante est proposé:
C
5
H
1i
0H + CH
3
COOH ---> CH
3
C00C
5
H
ii
+ H
2
0
Introduire dans un ballon 8,0 mL de 3-méthylbutan-1-ol
(A)
et 15 mL d'acide éthanoïque
(B),
ajouter 0,1 mL d'acide sulfurique (C) à 5 mol. L
-1
Masses
molaires: M
A
= 88,15 g.mol
-1
et M
8
= 60,05 g.mol
-1
.
Densités: d
A
= 0,81 et d
B
= 1,05.
• Calculer les quantités de matière des espèces chimiques: n
A
= 7,4.10
-2
mol,
n
B
=
0,26 mol et n
e
= 5.10
-4
mol
• Identifier le rôle de chaque espèce chimique introduite: A et B sont des réactifs, C un catalyseur.
• Identifier, s'il y a lieu, le réactif limitant et le réactif en excès : A est limitant et B est en excès.
Exey-d..e.
5
7,
516
La synthèse organique est une discipline dans laquelle de nombreux paramètres sont à prendre en compte afin d'obtenir des produits purs avec
de bons rendements, en toute sécurité et à moindre coût.
Dans ce chapitre, afin d'alléger les équations chimiques, l'écriture simplifiée suivante pourra être utilisée :
oxydation
C
2
H
5
OH CH
3
COOH
Cette représentation, qui suffit dans certains cas, sera appelée équation chimique. Il s'agit d'un abus de langage puisqu'elle ne fait pas
apparaître la totalité des réactifs et des produits.
101 Sécurité et coût •
Aclivili5
1 p. 498
el
2 p. 500
Dans un laboratoire, des règles assurent la sécurité de tous. Elles portent sur :
• la tenue vestimentaire (blouse, lunettes, gants);
• les déplacements (ne pas courir, ne pas renverser);
• les précautions à prendre selon les risques liés aux réactifs (Fig.
1);
• la sécurité des montages (température, pression, verrerie bien fixée);
• le traitement des déchets (ne pas jeter n'importe quoi à l'évier, utiliser les poubelles adaptées).
Le coût d'une synthèse s'estime à partir des prix des réactifs et des solvants. En cas de chauffage fort ou prolongé, le coût énergétique
occasionné doit être pris en compte.
Analyse des protocoles
2.1 Espèces chimiques mises en jeu
Un protocole décrit les espèces chimiques (réactifs, solvant et catalyseur) à introduire et leurs quantités respectives.
Les réactifs peuvent ou non être introduits dans les proportions stoechiométriques.
m
Rappel :
n M
—
=
avec
n
la quantité de matière,
m
la masse, M la masse molaire,
V
le volume, p la masse volumique,
d
la densité et p
eau
la masse volumique de l'eau.
1
/
4
100%