géologie générale

1
1
Pr. Zine El Abidine El Morjani
GÉOLOGIE GÉNÉRALE:
GÉOCHRONOLOGIE ABSOLUE
2
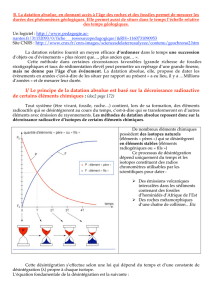
La datation relative issue de la stratigraphie permet d’ordonner dans le temps les événements les
uns par rapport aux autres, mais ne donne ni leur durée exacte, ni leur âge par rapport à l'actuel.
Il est donc impossible par cette approche de chiffrer (en millions d’années) l’âge d’un
phénomène géologique, ou l'âge des diverses couches géologiques, ou l'âge de la Terre.
La datation absolue permet, au contraire, d'établir l’ âge et la durée des structures et des
événements géologiques et biologiques. Elle permet, en outre, de dater certains repères de la
chronologie relative
Il fallait attendre la découverte de la radioactivité par Marie et Pierre Curie, au début du
20esiècle, pour avoir un outil de datation du temps géologique et de déterminer l'âge de notre
planète et de notre système solaire.
Cet outil, la datation radiométrique, est basée sur le principe de la désintégration radioactive
d’isotopes instables de certains éléments chimiques.
La radioactivité correspond à des changements naturels ou artificiels du nombre de protons et
de neutrons de noyaux dits instables
3. Chronologie Absolue
3.1 Introduction

2
3
Etablissement
du temps absolu
pour l'échelle géologique
3.1 Introduction
4
Age du système solaire
Age donné par les météorites les plus primitives du
système solaire :
CHONDRITES
T = 4.566 Ga +/- 2 Ma par la méthode U/Pb
3.1 Introduction

3
5
Rappels sur l’atome
La matière est formée de minuscules entités : les atomes.
Chaque atome est constitué :
A: Masse atomique:égal au nombre de protons (+) + nombre de neutrons (±)
Z: Numéro atomique: égal au nombre de protons (+)
Par convention, un atome d’un élément chimique est désigné de la façon suivante
K
39
19
La différence (A – Z) donne donc le nombre de neutrons.
Un atome étant neutre électriquement, il renferme autant de protons que d’électrons.
1. Un noyau : formé deux types de particules:
protons (+) neutrons (±)
2. Les électrons qui gravitent autour du noyau
Exemples:
3.1 Introduction
X
A
Z
C
12
6
Les protons et les neutrons sont « collés » les uns aux
autres grâce à une force de cohésion appelée
«interaction nucléaire » qui est généralement
suffisante pour les maintenir ensemble. On dit alors que
le noyau est stable.
6
Les isotopes sont des atomes d’un même élément chimique qui ont le même nombre de protons
mais un nombre de neutrons différents
-Le carbone « normal » « carbone 12 » ou « carbone » est stable
- Par contre le « carbone 14 » est radioactif.
Exemples
Les isotopes de l’hydrogène
Les isotopes du carbone 12C, 13C et 14C
11H 21H 31H
126C 136C 146C
Hydrogène, deutérium et tritium
Isotopes et radioactivité
3.1 Introduction
Dans la nature, la plupart des noyaux d’atomes sont stables et demeurent invariants dans le temps
contrairement aux atomes instables, qui sont dits radioactifs, ou radio-isotopes ou
radionucléides.
Ces noyaux instables contiennent trop de particules ou renferment trop d’énergie de sorte que la
force de cohésion n’est plus suffisante pour maintenir les protons et les neutrons ensemble. Les
noyaux sont « instables ».

4
7
Un noyau instable finit par libérer son trop plein d’énergie en émettant des rayonnements (alpha
ou bêta). Il se décompose spontanément en donnant naissance à un noyau différent et stable.
C’est le phénomène de désintégration du noyau qu’on appelle radioactivité
Émission d’un petit
noyau, constitué de 2
protons et 2 neutrons =
particule alpha
Émission d’un électron (-) par
transformation dans le noyau d’un
neutron en un proton.
d'où une perte de 4 dans A
et une perte de 2 dans Z
Il y a donc gain de 1 proton, d'où
un gain de 1 à Z, mais aucun
changement de masse atomique A
Isotopes et radioactivité
3.1 Introduction
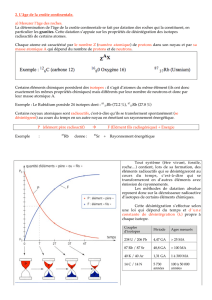
Un exemple : la désintégration de l'uranium 238 (238U) en plomb 206 (206Pb)
UPb
émission de 8 α
émission de 6 β
238
92
206
82
L'émission de 8αentraîne perte de 32 à la masse atomique ( 8 x (2 protons + 2 neutrons)), et une perte de 16
au numéro atomique ( 8 x 2 protons).
L'émission de 6βentraîne perte de 6électrons à la masse atomique , donc un gain de 6au numéro atomique.
Le bilan des gains et pertes s'établit donc ainsi: masse atomique: 238 - 32 = 206
numéro atomique: 92 - 16 + 6 = 82
8
Les Radioéléments naturels et induits
Elément radioactif
intégré dans les
minéraux de la roche
depuis la cristallisation à
partir du magma (qui
contenait aussi ces
éléments chimiques)
Elément radioactif
formé en haute
atmosphère et à la
surface terrestre par
l'effet du rayonnement
cosmique
Sources des éléments radioactifs
3.1 Introduction

5
9
La radiochronologie est basée sur la décroissance radioactive d’isotopes de certains éléments
chimiques.
Un élément radioactif père P ( radiogène) est instable se désintègre au cours du temps en donnant
un élément fils stable F (radiogénique) avec émission de particules
3.2 Principe de la radiochronologie
PF
Les physiciens ont prouvé que chaque radio-isotope est caractérisé par une constante de
désintégration λqui correspond à la proportion d’élément père qui se désintègre chaque année. Le
nombre d'atomes pères se désintégrant diminue de manière continue en même temps que le
nombre d'atomes fils augmente proportionnellement
Désintegration
Au temps to, il existe une quantité Pod’atomes radioactifs.
Après 1 an, il a y désintégration de λPoatomes ; il reste
donc P1= Po-λPoatomes.
Après 2 ans, il a y désintégration de λP1 atomes ; il
reste donc P2= P1-λP1atomes
La désintégration de l'élément Psuit une loi
exponentielle exprimée par une équation qui décrit le
changement (dP) du nombre d'atomes pères (P) par
intervalle de temps (dt): d P
d t = -λP
où :Pest le nombre d'atomes pères à l’instant t
λest la constante de désintégration de l'élément radioactif
exprimé en (an-1).
10
ÎLn P - Ln P0= - λt
ÎLn (P/P0) = - λt
Î(P/P0) = e-λt
ÎP = P0.e-λtou bien P0= P.e λt
dP/d t = -λP ÎdP / P = -λd t
ÎLn P = -λt+ Cte
Appliquée au temps t0 :
Ln P0= Cte
donc Ln P = -λt+ Ln Po
Mais en réalité dans une roche on mesure le nb d'éléments Pères Pet fils radiogénique F
Avec P0= P + F ÆF = P0-P
eλt =Po
Pλt = ln ( )
Po
Pt = ln ( )
Po
P
1
λ
Ppeut être mesuré dans l’échantillon par spectromètre de masse .
P0inconnu car variable d’une roche à l’autre
1
t = ln ( )
P + F
P
λ
donc
∫∫ −= tP
Pdt
P
dP
0
0
λ
F = P.eλt–P = P (e
λt–1)
Or le nb d’isotope fils total a un instant t (Ft) est égal a la somme des isotope fils initiaux (Fo) et
des isotopes fils radiogéniques (F) ÆFt= F0+ F
L’âge sera donc
Î
ÎÎ
1
t = ln ( 1 + )
P
λ
F
1
t = ln ( 1 + )
P
λ
Ft–F
0
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%