Mélanges et transformations Partie 1. Changements d`état isobares

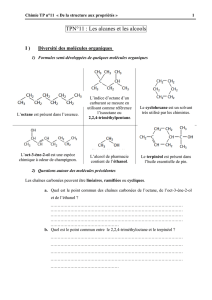
-1-
Mélanges et transformations
Partie 1. Changements d’état isobares de mélanges binaires
1.7. Utilisations des changements d’état liquide-vapeur au laboratoire
Objectifs du chapitre
→ Notions à connaître :
F Distillation simple
F Distillation fractionnée
F Distillation hétéroazéotropique
→ Capacités exigibles :
F Interpréter une distillation simple, une distillation fractionnée, une distillation hétéroazéotropique
à l’aide des diagrammes isobares d’équilibre liquide-vapeur.
Les opérations de séparation sont fréquentes en chimie.
Séparer sous-entend de placer dans des endroits différents, des entités initialement mélangées.
Par conséquent, toute action de séparation nécessite de modifier la composition du mélange initial.
A quelle condition la vaporisation permet-elle de modifier la composition de la phase liquide ?
Qu’est-ce qu’une distillation ?
En vue de séparer des constituants initialement au sein d’un même liquide, la distillation peut prendre trois formes :
• Distillation simple
• Distillation fractionnée
• Distillation hétéroazéotropique
Problématiques :
• Pourquoi la distillation fractionnée permet-elle généralement de séparer des
composés miscibles à l’état liquide ? Quand ne le permet-elle pas ?
• Pourquoi créer un mélange de liquides non miscibles peut-il permettre de séparer des
composés miscibles ?

-2-
1. Méthodes de distillation NON hétéroazéotropiques
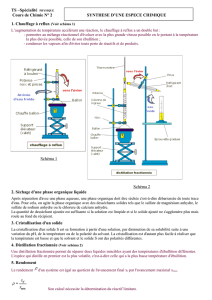
1.1. Distillation simple
- Schéma du montage :
Pourquoi qualifie-t-on cette distillation de « simple » ?
- Composition du distillat : Soit le diagramme de phases relatif au changement d’état liquide-vapeur d’un mélange de deux
constituants A
1
et A
2
, totalement miscibles à l’état liquide.
T P = cste
Quel est le constituant (A
1
ou A
2
) le plus volatil ?
x
2
Par construction graphique, montrer que le distillat est enrichi, par rapport au liquide initial, en constituant le plus volatil.

-3-
La distillation simple permet-elle de séparer deux constituants miscibles à l’état liquide ?
Citer deux situations où cette technique est utilisée.
1.2. Distillation fractionnée
- Schéma du montage : Distillation fractionnée sous pression atmosphérique
Quelle est la différence majeure avec la distillation simple ?
Quel est le sens du gradient de température ?
Pourquoi est-ce une amélioration par rapport à la distillation simple ?

-4-
- Composition du distillat : Soit le diagramme de phases relatif au changement d’état liquide-vapeur d’un mélange de deux
constituants A
1
et A
2
, totalement miscibles à l’état liquide. A
1
plus volatil que A
2
Par construction graphique, déterminer la composition du distillat.
T P = cste
x
2
Au cours de la distillation fractionnée, comment évolue la composition du liquide contenu dans le ballon ? Que peut-on en
déduire concernant le suivi de la température en tête de colonne ?
T P = cste
x
2

-5-
Réalisation de la distillation fractionnée
http://goo.gl/9HK0GR
- Cas des composés à forte température d’ébullition :
Pourquoi est-il difficile de séparer des composés à forte température d’ébullition par distillation fractionnée ?
Pourquoi le montage de « distillation fractionnée sous pression réduite » est une solution à ce problème ?
Dans quelle autre opération de distillation au laboratoire utilise-t-on une pression réduite ? Pourquoi ?
Distillation fractionnée :
• Intérêt : Séparation possible de deux liquides miscibles
o Distillat : Composé le plus volatil
o Résidu : Composé le moins volatil
• Limites : La qualité de séparation dépend de la colonne. Au laboratoire de chimie, les colonnes
arrivent à séparer les constituants si leurs températures d’ébullition diffèrent d’au moins 25°C.
• Exemples d’utilisation :
o Purification d’un produit liquide à la fin d’une synthèse
o Déplacement d’un équilibre chimique en éliminant du milieu par distillation le
produit formé le plus volatil (cela suppose la miscibilité à l’état liquide).
 6
6
 7
7
 8
8
 9
9
1
/
9
100%