oxydation deshydrogenante du propane en composes

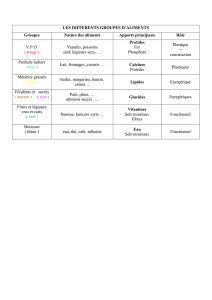
1
Mme TASSADIT MAZARI épse HACHI*
Laboratoire de Chimie du Gaz Naturel, Faculté de Chimie, USTHB
(*)Thèse de Doctorat
Directeur de thèse : Mme Chérifa RABIA, Professeur à l’USTHB
OXYDATION DESHYDROGENANTE DU PROPANE EN COMPOSES
OXYGENES SUR DES PHOSPHOMOLYBDATES SUBSTITUES
(PMo11M ET MPMo12) M=Ni, Fe ou Co
Résumé :
Deux séries de sels d’ammonium (NH4)6HPMo11MO40 (PMo11M) et des sels mixtes
ammonium-métal de transition (NH4)2.5MzHyPMo12O40 (MPMo12) avec M = Ni, Co ou Fe ont été
préparés et caractérisés par différentes techniques d’analyse notamment par spectroscopies Infra-
Rouge (IR) et UV-Visible, RMN du phosphore, diffraction des rayons X (DRX), thermo diffraction
des rayons X (XRTD), analyse thermique (ATG, DSC) et analyse BET. Leur formulation a été
vérifiée par analyse élémentaire (ICP). Les propriétés acido-basiques et rédox des sels ont été évaluées
dans la réaction de conversion de l’isopropanol dans l’intervalle de température150-250°C et les
performances catalytiques dans l’oxydation du propane entre 380 et 420°C avec 2 vitesses de chauffe
de 5 et 9°C/min.
L’analyse élémentaire a confirmé la formulation des différents sels. L’analyse par
spectroscopie Infra-rouge a montré que tous les sels préparés présentent les bandes de vibration
caractéristiques de l’anion de Keggin, [PMo12O40]3-. Cependant, en présence des sels PMo11M, en plus
d’un léger déplacement des bandes de l’anion de Keggin vers les faibles fréquences, des épaulements
sur la bande P-Oa apparaissent, confirmant ainsi la substitution de l’atome de molybdène par un métal
de transition. Les diffractogrammes RX des sels, MPMo12, sont analogues à ceux du sel
(NH4)3PMo12O40 qui cristallise dans une structure cubique Pnˉ3m alors que ceux des sels PMo11M sont
différents de ceux du sel (NH4)3PMo12O40 et de l’acide H3PMo12O40 cristallisant dans un système
triclinique. La spectroscopie UV-Visible a montré pour l’ensemble des sels, une large bande de
transfert de charge oxygène-molybdène (VI) dans le domaine spectral 250-500nm. En plus de cette
bande, une autre apparaît vers 620-720nm en présence des sels à base de cobalt attribuée au
molybdène (V) suggérant qu’ils sont partiellement réduits. Il ressort des résultats des analyses BET
que les propriétés de surface, dépendent aussi bien de la composition de l’unité de Keggin que de
celle du contre-ion. Les résultats des analyses thermiques (TG-DSC) montrent que la série MPMo12 est
moins stable que la série PMo11M. Les tests d’acidité ont montré que la différence de comportement
entre les deux séries de sels dépend essentiellement de la température. Ainsi, à basse température
(150°C), le pouvoir oxydant varie comme suit Ni>Co>Fe et à température plus élevée (200-250°C),
tous les solides présentent un caractère acide prononcé.
L’étude de la réactivité de ces sels dans la réaction de déshydrogénation oxydante du propane a
permis de cerner l’influence des conditions opératoires (température, vitesse de chauffe) et de la nature
et de la position (comme ion de coordination ou comme contre-ion) de l’élément de transition M, dans
le polyoxométallate sur leur performance catalytique. Les solides présentant des comportements
catalytiques différents, se sont avérés être actifs et sélectifs en propène et/ou acroléine. Les meilleurs
rendements en produits sont obtenus à basse température 380°C et avec une vitesse de chauffe de
9°C/min. Parmi, les différents sels étudiés, FePMo12 se présente comme le catalyseur le plus actif et le
plus sélectif en propène avec un rendement de 17,2% et un rendement en oxydes de carbone que de
3%.

2
I.INTRODUCTION
La fonctionnalisation du propane, qui est plus abondant et moins coûteux que le
propène, en oléfine, aldéhyde et acide est d’un grand intérêt industriel. Parmi, les
matériaux étudiés dans l’oxydation du propane, les polyoxométalates de type Keggin ont
été rapportés comme étant actifs et sélectifs. Dans le cas de l’oxydation du propane en
acide acrylique, de bonnes performances catalytiques ont été obtenues par Mizuno et coll
[1,2] sur le sel Cs2.5Fe0.08H1.26PMo11VO40 et Ueda et coll [3] sur le sel de pyridinium de
l’acide H3PMo12O40. Des études ont montré que les tungstophosphoriques lacunaires
(PW11) modifiés avec un métal de transition (Fe ou Mn) sont des catalyseurs sélectifs en
oxydéshydrogénation du propane en propène [4]. Ils ont montré également que
l’hétéropolyanion était stable sous les conditions opératoires, lorsqu’il se trouvait dans un
état réduit. Il a été rapporté également que les sels Cs2.5H6x-yM1-xPMo11-xVMxO40 (M=Co,
Fe, Ni, Ga, Sb ou Zn) sont actifs dans l’oxydation du propane dans l’intervalle de
températures 340-400°C et que l’introduction d’un métal de transition dans l’unité de
Keggin favorisait la formation du propène et en position de contre-ion et celle de l’acide
acétique [5]. Sur les polyoxométalates de formule Cs2.5H1.5PVMo11-xWxO40 (x=0, 1, 2, 4 et
6), Dimitratos et coll [6] ont montré que les propriétés catalytiques dépendaient de la
température de prétraitement et de la valeur de x. Il a été également montré par que le sel
d’ammonium de l’acide H3PMo12O40 ((NH4)3PMo12O40) est un catalyseur actif et sélectif
en acide méthacrylique dans l’oxydation de l’isobutane [7-10]. Dans ces travaux, il a été
observé que la présence d’un métal de transition et/ou celle d’un groupement organique
dans les composés phosphomolybdiques pouvait jouer un rôle déterminant dans le
processus redox. Ainsi, il a été constaté qu’un état partiellement réduit du catalyseur le
rendait stable sous les conditions de la réaction d’une part et que d’autre part, il conduisait
à de meilleures sélectivités en produits d’oxydation partielle tout en réduisant la
combustion totale de l’alcane.
Dans ce travail, il nous a semblé intéressant d’introduire aussi bien des ions
ammonium que des ions des métaux de transition (Ni2+, Co2+ ou Fe3+) dans des
phosphomolybdates de type Keggin dans le but d’obtenir des catalyseurs actifs et sélectifs
en produits valorisables en oxydation du propane. Pour atteindre cet objectif, dans la
première partie de ce travail, l’atome de molybdène du système, H3PMo12O40, a été
substitué par l’un des ions Fe3+, Ni2+ ou Co2+ (position anionique) et les protons par des

3
ions ammonium (position cationique). Les sels obtenus dans ce cas ont pour
formule (NH4)6HPMo11MIIO40 (M:Co, Ni) et (NH4)6PMo11FeIII(H2O)O39, notés PMo11M.
Dans la seconde partie de ce travail, les ions ammonium et les ions des métaux de
transition (Ni2+, Co2+ ou Fe3+) sont tous les deux en position de contre-ions dans l’anion
de Keggin, [PMo12O40]3-, les sels ainsi obtenus ont pour formule (NH4)2.5MxHyPMo12O40
(noté MPMo12). La composition chimique des sels a été déterminée par analyse
élémentaire ICP. La structure de Keggin, correspondant à l’anion PM12O403- a été vérifiée
par spectroscopie Infra-Rouge à transformée de Fourrier (IRTF) et l’état d’oxydation du
molybdène ainsi que les différents transferts de charge ligand-métal par spectroscopie UV-
Visible. La pureté des sels préparés a été examinée par RMN du phosphore. La surface
spécifique et la porosité sont déterminées par la méthode BET. La structure cristalline ainsi
que son évolution en fonction de la température ont été examinées par diffraction des
rayons X (DRX) et par thermodiffraction des rayons X (XRTD). Le comportement
thermique des sels a été étudié par analyse thermique (ATG et DSC). Leurs propriétés
acido-basiques et rédox ont été évaluées dans la réaction de conversion de l’isopropanol
dans l’intervalle de température150- 250°C. Les deux séries de sels ont été testés dans
l’oxydation du propane entre 380 et 420°C avec des vitesses de chauffe de 5 et 9°C/min
pour le prétraitement oxydant in-situ des catalyseurs.
II. SYNTHESE, CARACTERISATION ET REACTIVITE DES
HETEROPOLYSELS (NH4)6HPMo11MO40 (M : Co, Ni, Fe)
II. 1 Synthèse des hétéropolysels
Les sels d’ammonium, PMo11M (M: Co, Ni ou Fe) ont été préparés en accord avec
les données de la littérature [11]. La synthèse est réalisée à 0°C afin d’éviter la formation
du 6- molybdométalate (composé de type Andersons). 250ml d’une solution de
paramolybdate d’ammonium (1M) sont ajoutés à un mélange constitué de 25,2ml de
H3PO4 (1M), 50ml de H2SO4 (0,5M) et de 25ml de Fe2(SO4)3 ou MSO4 (1M). Ensuite, du
nitrate d’ammonium (NH4NO3) est ajouté pour précipiter les sels. Les sels à base de Ni et
de Fe sont jaunes, celui à base de Co brun. Les solides sont conservés à l’abri de l’humidité
pour éviter une décomposition progressive.

4
II.2 Caractérisation des solides
II.2.1 Composition chimique des sels
Le tableau II.1 présente les résultats de l’analyse chimique des hétéropolysels déterminée
par ICP. Ils sont en bon accord avec les formules théoriques supposées pour le
phosphore (1 atome par unité de Keggin) et le métal de transition (1 atome par unité de
Keggin). Le nombre d’atomes d’azote par polyoxométallate est très inférieur à la valeur
théorique (2,02- 2,70 contre 6). Ceci est dû à la perte des ions ammonium, en plus des ions
nitrates lors du traitement thermique du solide avant analyse. Les formules des sels sont les
suivantes : (NH4)6HPMo11FeO 39(H2O), (NH4)6HPMo11NiO40 et (NH4)6HPMo11CoO40..
Tableau II.2.1 : Analyse élémentaire des hétéropolysels PMo11M
PMo11M
Composition (%)
P
Mo
M
N
Rapport
Mo/P
molaire
M/Mo.11
N/Mo.11
PMo11Fe
1,05
57,46
3,48
1.54
11,31(11)
0,97(1)
2,02(6)
PMo11Co
1,02
57,29
3,18
1,59
10,88(11)
0,89(1)
2,01(6)
PMo11Ni
1,01
56,85
2,57
1.75
10,85(11)
0,81(1)
2,70(6)
( ) Coefficient stœchiométrique théorique
II.2.2 31P MAS-RMN
Le spectre 31P RMN en solution du sel PMo11Ni (Figure II.2.1), présente 2 pics
suggérant que le sel est un mélange de deux espèces à base de phosphore. Le premier pic à
-1,15 ppm pourrait être assigné à l’espèce lacunaire [PMo11O39]7− [12] et celui à 0.00ppm
au sel PMo11Ni. PMo11Fe et PMo11Co ne présentent aucun signal en 31P RMN dû à l’effet
paramagnétique des ions Fe3+ et Co2+ [13].
Figure II.2 .1: Spectre 31P RMN de PMo11Ni
0.0000
-1.1551
(ppm) -9-8
-7
-6-5-4-3-2-10123456789
0.0000
-1.1551
(ppm) -9-8
-7
-6-5-4-3-2-10123456789

5
II.2. 3 Analyse de surface
Les surfaces spécifiques, le volume des pores, la surface des micropores ainsi que
le diamètre des pores des différents solides sont représentés dans le tableau II.2.2. Les
résultats obtenus montrent que les surfaces spécifiques des sels PMo11M sont très faible (1-
5m2/ g) du même ordre de grandeur que celle de l’acide H3PMo12O40 (<10m2/g) et très
inférieures à celle du sel d’ammonium (NH4)3PMo12O40 (222m2/g) [14]. Le diamètre des
pores se situe entre 58 et 72Å, ceci indique que ces composés sont de nature mésoporeuse.
Il est à noter que le sel PMo11Fe présente les paramètres les plus faibles, probablement liés
à la charge de l’ion ferrique (Fe3+) par conséquent à son rayon plus petit que ceux des ions
Co2+ et Ni2+. Les isothermes d’adsorption-désorption d’azote et les hystérésis des
différents sels sont de types II et B respectivement.
Tableau II.2.2: Surface spécifique, volume et surface des micropores et diamètre moyen
des pores des sels PMo11M.
solide
SBET
(m2/g)
Volume des
micropores
(cm3/g)
Surface des
micropores
(m2/g)
Volume des
pores (cm3/g)
Diamètre
moyen des
pores (Å)
PMo11Fe
1
1,2 10-4
0,3
7,9 10-4
58,7
PMo11Co
3
4,110-4
0,9
46,010-4
64,0
PMo11Ni
5
6,1 10-4
1,5
85,010-4
72,1
II.2.4 Spectroscopie UV-Visible
Les spectres UV-Visible des différents sels (Figure II.2.2) présentent une large
bande dans le domaine spectral 200-550nm, constituée de deux composantes situées à 200-
380 et 400-550nm. Ces différentes composantes seraient associées aux différents types
d’atomes d’oxygène de l’anion de Keggin, aux transitions de transfert de charge inter-
anion et à la nature du contre-ion [8, 15-17]. En plus de cette large bande, une autre de plus
faible intensité est observée dans la région 600-720nm en présence de PMo11Co. Elle est
attribuée soit à la bande de transition d-d des espèces d1 Mo(V) en coordination
octaédrique et/ou aux espèces d6Co(III) également en coordination octaédrique [9,18-21].
Ces observations suggèrent une réduction partielle des ions Mo (VI) en Mo (V) avec un
transfert de charge selon l’équation redox (1):
Co2+ + Mo6+ Co3+ + Mo5+ (1)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%