corrigé

Correction
Exercice 1
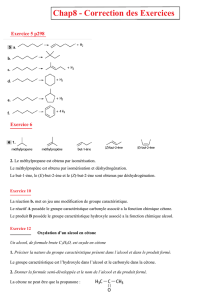
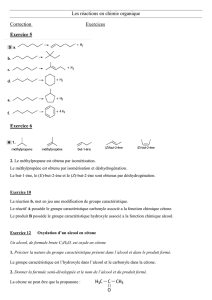
1. La représentation topologique est équivalente à la formule développée suivante:
2. Les groupes caractéristiques présents dans cette molécule sont notés en bleu. De gauche à droite il
s'agit du groupe carbonyle et du groupe carboxyle.
3. Le groupe carbonyle correspond ici à la fonction (famille) cétone (R1—CO—R2) et le groupe
carboxyle correspond à la fonction (famille) acide carboxylique (R—COOH).
4. La présence du groupe carbonyle et donc la famille des cétones qui lui correspond peut être mis en
évidence par action de la 2,4-dinitrophénylhydrazine (DNPH) avec laquelle une cétone donne un
précipité jaune-orangé de 2,4-dinitrophénylhydrazone.
La présence du groupe carboxyle et donc de la famille des acides carboxyliques qui lui correspond
peut être mis en évidence grâce à son caractère acide. En présence de cette molécule le bleu de
bromothymol vire au jaune.
5. La chaîne carbonée de cette molécule présente une insaturation de type éthylénique (liaison double
C=C). On peut mettre en évidence la présence de ce type d'insaturation par action du dibrome. Il
suffit de faire réagir cette molécule avec de l'eau de brome (dibrome en solution aqueuse). On
observe la décoloration de la solution de dibrome.
6. Autour de la double liaison les atomes et les groupes d'atomes se répartissent suivant le schéma
AHC=CHB. Ce type de structure donne lieu à une isomérie Z-E. L'isomère proposé dans l'énoncé
est l'isomère E. L'isomère Z est présenté ci-dessous:
Exercice 2
1.
famille des aldéhydes
propanal
famille des cétones
pentan-2-one
2. Ces deux molécules présentent le groupe carbonyle. Elles réagissent donc toutes les deux avec la
2,4-dinitrophénylhydrazine (DNPH) pour donner un précipité jaune-orangé de 2,4-
dinitrophénylhydrazone.
3. Pour différencier ces deux molécules il suffit de tenter de les faire réagir avec un réactif spécifique
de l'une d'entre elles. Par exemple, en utilisant la liqueur de Fehling, réactif spécifique des
aldéhydes, on obtiendra un précipité rouge brique d'oxyde de cuivre (I) Cu2O avec le propanal et
aucune réaction avec la pentan-2-one.

Exercice 3
1. Un test positif à la DNPH se traduit par la formation d'un précipité jaune-orangé de 2,4-
dinitrophénylhydrazone.
2.Un test positif à la liqueur de Fehling se traduit par la formation d'un précipité rouge brique d'oxyde
de cuivre (I) de formule Cu2O.
3. Il s'agit d'un précipité de chlorure d'argent.
4. L'identification des liquides contenus dans les flacons peut être résumée de la façon suivante:
Flacon
Composé
Justification
A
Chloroéthane
Seuls les composés halogénés donnent un précipité avec le nitrate
d'argent en solution alcoolique.
B
Butylamine
C'est le seul composé donnant une solution aqueuse basique.
C
Propanone
C'est un composé carbonylé ("+" DNPH) mais ce n'est pas un
aldéhyde ("–" liqueur de Fehling).
D
Acide
éthanoïque
C'est le seul acide présent.
E
Propanal
C'est un composé carbonylé ("+" DNPH), c'est aussi un aldéhyde
("+" à la liqueur de Fehling).
F
Propan-2-ol
C'est le seul qui reste et un alcool est neutre et ne donne aucune
réaction avec la DNPH (pas de groupe carbonyle).
5. Le test à la liqueur de Fehling est inutile puisque ce composé ne présente pas de groupe carbonyle
(pas de réaction avec la DNPH) donc cette molécule ne peut pas être un aldéhyde susceptible de
donner une réaction avec la liqueur de Fehling.
Exercice 4
Les réponses sont regroupées dans le tableau suivant:
CH3—CH2—OH
alcool primaire
CH3—CH2—CH2—OH
alcool primaire
alcool secondaire
alcool secondaire
Exercice 5
Rappelons que l'oxydation ménagée d'un alcool primaire donne un aldéhyde et éventuellement un
acide carboxylique (en cas d'excès de l'oxydant) et l'oxydation ménagée d'un alcool secondaire donne
une cétone. On peut alors dresser le tableau suivant:

Composé oxygéné
Formule du composé oxygéné
Alcool oxydé
Formule de l'alcool
butanal
butan-1-ol
butanone
butan-2-ol
acide butanoïque
butan-1-ol
propanone
propan-2-ol
acide propanoïque
propan-1-ol
acide éthanoïque
éthanol
Exercice 6
1. Les groupes caractéristiques sont présentés en couleur ci-dessous:
en rouge: groupe hydroxyle
en bleu: groupe carboxyle
en vert: groupe carbonyle
2. La fonction alcool secondaire de l'acide lactique peut être transformée par oxydation ménagée en
cétone. Les deux molécules sont donc associées dans un couple du type cétone / alcool secondaire.
Il s'agit d'un couple oxydant / réducteur ou couple rédox. L'acide pyruvique, présentant une fonction
cétone, est un oxydant (capteur d'électrons) et l'acide lactique, présentant une fonction alcool
secondaire, est un réducteur (donneur d'électrons).
3. En écrivant les demi-équations rédox puis le bilan on a:
CH3—CHOH—COOH
=
CH3—CO—COOH + 2H+ + 2e-
x 5
MnO4– + 8H+ + 5e-
=
Mn2+ + 4H2O
x 2
5CH3—CHOH—COOH + 2MnO4– + 6H+
5CH3—CO—COOH + 2Mn2+ + 8H2O
Exercice 7
1. La formule semi-développée du menthol est donnée ci-contre.
2. Le menthol présente une fonction alcool secondaire qui est oxydée en cétone pour donner la
menthone. La formule semi-développée de la menthone et sa représentation topologique sont
données ci-dessous.

3. En écrivant les demi-équations correspondant à chaque couple mis en jeu puis le bilan
En écrivant les demi-équations correspondant à chaque couple mis en jeu puis le bilan on a:
C10H20O
=
C10H18O + 2H+ + 2e-
x 5
MnO4– + 8H+ + 5e-
=
Mn2+ + 4H2O
x 2
5C10H20O + 2MnO4– + 6H+
5C10H18O + 2Mn2+ + 8H2O
4. La quantité de matière de menthone réellement obtenue est:
n(menthone) = m / M = 30,7 / 154,0 = 0,200 mol
La quantité de matière initiale de menthol est:
n0 = m / M = 39,0 / 156,0 = 0,250 mol
Déterminons la quantité de matière de menthone que l'on obtiendrait si la réaction était complète à
l'aide du tableau d'avancement de la réaction. Nous considérerons que l'oxydant est en excès, ou,
ce qui revient au même, que le menthol est le réactif limitant. Dans ce tableau nous ne ferons figurer
que les espèces dont nous avons besoin, c'est-à-dire le menthol et la menthone.
Équation de la réaction
5C10H20O + 2MnO4- + 6H+ 5C10H18O + 2Mn2+ + 8H2O
Etat initial (mol)
n0=0,250
n(menthone)0=0,000
Etat à la date t
l'avancement est x
n=n0-5x
n(menthone)=5x
Etat final (mol)
l'avancement est xmax(mol)
nf=n0-xmax
n(menthone)f= 5xmax
Le réactif limitant est le menthol. Donc dans l'état final nf=0 alors
n0-5xmax = 0 => xmax = n0 /5 alors nf(menthone) = 5 n0 /5 = n0
Le rendement = n(menthone) / nf (menthone) = 0,200 / 0,250 = 0,800 = 80 %.
Exercice 8
1. En écrivant les demi-équations correspondant au couples mis en jeu puis l'équation bilan on a:
CH3—CH2—OH + H2O
=
CH3—COOH+ 4H+ + 4e-
x 5
MnO4– + 8H+ + 5e-
=
Mn2+ + 4H2O
x 4
5CH3—CH2—OH + 4MnO4– + 12H+
5CH3—COOH + 4Mn2+ + 11H2O
2. La teinte rose, due à la présence des ions MnO4-, est persistante dès que l'équivalence est
dépassée à une goutte près. En effet, après l'équivalence, l'éthanol est le réactif limitant. MnO4- est
alors en excès et colore la solution en rose.
A l'équivalence (déterminée à la goutte près) les réactifs ont été mélangés dans les proportions
stoéchiométriques, soit:
n(éth) / 5 = n(per)/4 = 5 n(per)/4 = 5 C0V0 / 4 = 5x0,25x19,2.10-3 / 4 = 6,0.10-3 mol
3. Cette quantité de matière d'éthanol correspond à une masse m d'éthanol telle que

m = n(éth) M(éth) = 6,0.10-3 x 46,0 = 0,28 g
le volume V d'éthanol correspondant est donné par :
µ = m / V => V = m / µ = 0,276 / 0,79 = 0,35 mL
la proportion (pourcentage) en volume d'éthanol dans le carburant est alors
Péth = V x100 / Vp = 0,35 x100 / 10,0 = 3,5%
le carburant est donc conforme à la législation.
Exercice 9
1. L'équation de la déshydratation s'écrit:
2. La quantité de matière d'alcène (2-méthylpropène) recueilli est:
n = V / Vm = 4,0 / 25,0 = 0,16 mol
3. La quantité de matière d'alcène qui se serait formée si la réaction avait été complète est donnée par
les proportions stoéchiométriques.
n (alcool) = n (alcene) = m(alcool) / M(alcool) = 16,0 / 74,0 = 0,22 mol
le rendement de cette préparation est alors = n / n(alcene) = 0,16 / 0,22 = 0,74 = 74%
1
/
5
100%