Inflammation - interactions leucocytes endothélium

La réponse Inflammatoire
La réponse Inflammatoire
Interactions leucocytes
Interactions leucocytes
endothélium
endothélium
Frédéric Bérard
Frédéric Bérard
Service Immunologie Clinique et Allergologie
Service Immunologie Clinique et Allergologie
CH Lyon Sud
CH Lyon Sud
Lyon le
Lyon le 15
15 octobre 2009
octobre 2009
M1 Immunologie et
M1 Immunologie et Immunopathologie
Immunopathologie

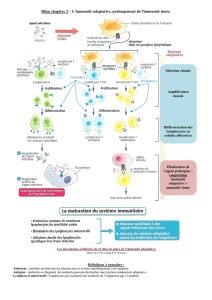
L’inflammation
L’inflammation
•
•Processus physiologique de défense de
Processus physiologique de défense de
l’organisme après une agression tissulaire
l’organisme après une agression tissulaire
•
•Vise à :
Vise à :
–
–éliminer
éliminer ou isoler
ou isoler l’agresseur (micro
l’agresseur (micro-
-organisme)
organisme)
–
–réparer le tissu
réparer le tissu
•
•Inflammation
Inflammation aigüe
aigüe : bénéfique
: bénéfique
•
•Inflammation chronique : délétère
Inflammation chronique : délétère

Keratinocytes
Cellule de Langerhans
Cellules endothéliales
Inflammation = danger
Inflammation = danger
(motifs moléculaires associés aux
(motifs moléculaires associés aux
agents infectieux, plaie, cytokines,
agents infectieux, plaie, cytokines,
hsp
hsp, allergènes,...)
, allergènes,...)

l’inflammation
l’inflammation aigüe
aigüe met en jeu
met en jeu
•
•L’Immunité innée :
L’Immunité innée :
–
–phase précoce
phase précoce
–
–nécessaire au déclenchement de la réponse
nécessaire au déclenchement de la réponse
adaptative
adaptative
•
•Immunité adaptative : phase tardive
Immunité adaptative : phase tardive

Cellules du système immunitaire
Cellule souche
hématopoiétique
Précurseur
lymphoide
Précurseur
myéloide
Lympho T Macrophage/
Monocyte/
Cell dendritique
Phagocytose
Presentation
antigénique
Cellules de
l’immunité
spécifique
Cellules de
l’immunité
spécifique
Eosinophile
Immunité anti
parasite
Basophile
Réponses
allergiques
Mastocyte
Inflammation
Réponses
allergiques
Neutrophile
Phagocytose
Antibacterien
Cellules de l‘Immunité Innée
Cellules de l‘Immunité Innée
Lympho B
NK Cells / LGL
Source: Goldsby RA et al. In: Kuby Immunology. 4th ed. New York: WH Freeman & Co; 2000: 28-29; 41-45.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%