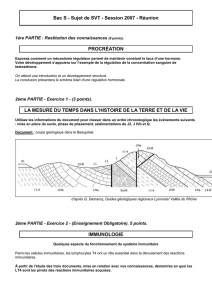
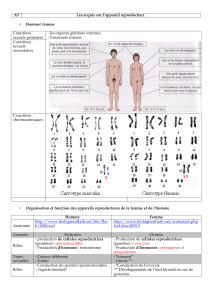
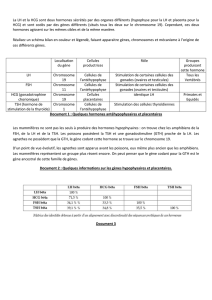
Un modèle d`étude de la différenciation lymphocytaire - iPubli

SYNTHÈSE
1992 562-71
Geneviève
de Saint Basile
Alain Fischer
U.

T
Plaquees
1

• GLOSSAIRE •
Cp G
AC
CD43

2
Figure 2.
locus locus

3.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%