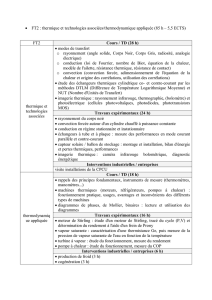
Sujet 3 (Changement phase corps purs)

Université Montpellier II 2014-2015
L2S3 HLPH312
Sujet 3 (Changements de phases des corps purs)
A. Fusion de l’eau (Extrait 2003.I.A)
Le changement d'état réversible solide-liquide (S-L) du corps pur eau (H
2
O) intervient à la
température T
0
; et sous la pression atmosphérique P
0
.
On rappelle la relation entre la chaleur latente de fusion du corps pur L
f
(T,P) et les volumes
massiques u
L
de sa phase liquide et u
S
de sa phase solide (relation de Clapeyron) :
ܮ
ሺܶ, ܲሻ= ܶሺݑ
− ݑ
ௌ
ሻ݀ܲ
݀ܶ
Sauf indications contraires, toutes les expériences décrites dans cette partie se déroulent sous la
pression P
0
.
Données numériques
l. Transferts :
1) Une masse M
S
de glace, initialement à la température T
1
;(T
1
<T
0
), est placée au contact d'une
source de chaleur (thermostat) maintenue à la température T
0
. En fin de transformation, la masse M
S
est entièrement liquide à T
0
.
1.1. Déterminer pour cette masse M
S
d’eau l`expression littérale de :
• la quantité de chaleur reçue
• le travail reçu
• la variation d’énergie interne
• la variation d’enthalpie
• la variation d’entropie.
1.2. Application numérique : M
S
= 1,00 kg; T
1
=253 K. Calculer numériquement les valeurs
déterminées dans la question 1.1.
2) Un calorimètre, thermiquement isolé et de capacité thermique négligeable, contient une masse
M
L
d’eau liquide, initialement à la température T
2
(T
2
>T
0
). Une masse M
S
de glace, initialement à la
température T
1
(T
1
<T
0
), est ajoutée dans le calorimètre.
2.1. Déterminer l’expression littérale de la température initiale minimale T
2,min
de la masse M
L
au-
dessus de laquelle, à l'équilibre, la masse totale (M
S
+ M
L
) d`eau est liquide.
2.2. Application numérique : M
S
= M
L
=1,00 kg ; T
1
=253 K . Calculer T
2,min
.
2. Cessation d’un état métastable
Dans un calorimètre thermiquement isolé et de capacité thermique négligeable, on place une masse
M
L
d’eau en état surfondu, c'est-à-dire liquide à une température T
3
inférieure à la température de

Université Montpellier II 2014-2015
L2S3 HLPH312
changement d`état réversible (T
3
<T
0
). L'introduction d'un germe cristallisé de glace, de masse
négligeable, provoque la solidification partielle de l'eau.
1) Quelle est la température finale T
f
à l`équilibre ?
2) Déterminer l’expression littérale de la masse m
s
d’eau solidifiée.
3) Même question pour la variation d’entropie ∆S de l'eau.
4) Application numérique : M
L
= 1,00 kg; T
3
=263 K
4.1. Calculer la masse d'eau solide m
s
.
4.2. Calculer la variation d'entropie ∆S.
4.3. Y a-t-il eu création d'entropie dans l’univers ? La transformation est-elle réversible ?
Partie B : Détente isotherme d’un mélange de 2 corps purs
(2011.I.C)
Aucune connaissance spécifique à la chimie en général, et aux équilibres binaires et solutions
idéales en particulier, n'est requise pour traiter cette partie.
Il s'agit de considérer une transformation isotherme réversible (grâce à un thermostat imposant une
température constante T
0
= 333 K) d'un système fermé, de volume variable et constitué d'un
mélange de deux corps purs: diazote N
2
et eau H
2
0.
Hypothèses de travail :
• le diazote N
2
demeure à l'état gazeux;
• la phase vapeur, constituée de diazote et de vapeur d'eau, se comporte comme un mélange idéal de
gaz parfaits: la pression totale Ptot est égale à la somme des pressions partielles P
N2
et P
H20
(Ptot=P
N2
+P
H20
) ;
• le comportement de « corps pur» manifesté par l'eau est indépendant de la présence du diazote;
• lorsque l'eau présente l'équilibre liquide-vapeur, il est admis que le diazote ne se dissout pas dans
l'eau liquide;
• le volume de la phase liquide est négligé devant le volume de la phase vapeur.
Données:
• P*( H
2
0 ; T
0
= 333 K) = 2,00 X 10
4
Pa: pression de vapeur saturante de l'eau à T
0
;
• ∆Hvap (H
2
0 ; T
0
= 333 K) = 4,25 X 10
4
J. mol
-1
: chaleur latente molaire de vaporisation de l'eau à
T
0
;
• R = 8,31 J. mol
-1
.K
-1
: constante du gaz parfait.
I. Corps pur eau (sans diazote)
Une quantité n
E
= 3,00 X 10
-1
mol d'eau pure (sans diazote) est envisagée, à T
0
= 333 K, à l'état de
vapeur tout juste saturante (avec une seule goutte de rosée) [état noté (0)].
1. Donner la pression P
E,0
de l'eau correspondant à cet état d'équilibre.
2. En déduire la valeur numérique du volume V
0
occupé par l'eau dans ces conditions.
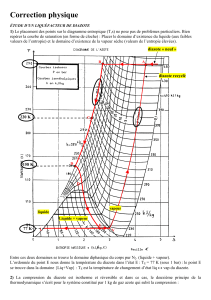
3. Les diagrammes P = f(T) et P = f(V), représentés sur la figure ci-dessous, sont les
diagrammes simplifiés, mais non annotés, du corps pur H
2
0. Recopier sommairement ces
deux diagrammes, les compléter et positionner le point représentatif du corps pur, dans l'état
(0), sur chacun des deux diagrammes.

Université Montpellier II 2014-2015
L2S3 HLPH312
4. À température T
0
= 333 K constante et de manière réversible, le volume du système précédent
est réduit de moitié (V
final
= V
0
/2) : calculer le travail W reçu (ou mis enjeu) par le corps pur eau
au cours de cette évolution.
II. Transformation d'un mélange diazote-eau
1. État initial (1) de la transformation.
À la quantité n
E
= 3,00 X 10
-1
mol d'eau précédente est ajoutée la quantité n
N
= 1,00 X 10
-1
mol de
diazote N
2
. La pression totale initiale du mélange est Ptot = 3,00 x 10
4
Pa, pour un nouveau volume
V
1
[état (1)].
a) Déterminer si, dans l'état initial (1), l'eau est sous forme de vapeur sèche ou de vapeur saturante.
b) Déterminer la pression partielle P
N2,1
du diazote N
2
dans cet état initial.
c) En déduire le volume initial V
1
du mélange.
d) Préciser la composition, en quantités de matière (n
E,liq,1
) et (n
E,vap,1
) de l'eau dans l'état initial (1).
2. État final (2) de la transformation.
Le mélange subit une détente isotherme réversible jusqu'à l'état (2) pour lequel la pression totale est
Ptot = 2,00 x 10
4
Pa.
a) Déterminer si, dans l'état final (2), l'eau est sous forme de vapeur sèche ou de vapeur saturante.
b) Déterminer la pression partielle P
N2,2
du diazote dans cet état final.
c) En déduire le volume final V
2
du mélange.
d) Préciser la composition, en quantités de matière (n
E,liq,2
) et (n
E,vap,2
) de l'eau dans l'état final (2).
3. Étude de la transformation (1) → (2).
Déterminer, au cours de cette transformation, le volume Vs du système pour lequel la vapeur d'eau
cesse d'être saturante.
1
/
3
100%