les hormones bio-identiques : foire aux questions

LES HORMONES BIO-IDENTIQUES : FOIRE AUX QUESTIONS
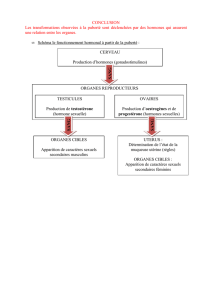
Qu’est-ce qu’une hormone bio-identique?
De façon naturelle, le corps de la femme produit de la progestérone et trois principaux
types d’oestrogènes : l’oestradiol, l’oestriol et l’oestrone . Les hormones que l’on
appelle « bio-identiques » sont fabriquées en laboratoire pour être des copies exactes
des hormones que notre corps produit. Les thérapies hormonales substitutives (THS)
standard impliquent l’utilisation d’hormones qui ne sont pas chimiquement identiques à
celles que l’on retrouve naturellement dans le corps humain. Ces produits ont des noms
comme le « sulfate d’oestrone » et « progestines ». Dans bien des cas, ces produits
proviennent d’hormones extraites de l’urine de jument gravide.
Quelles sont vos recommandations et comment les comparer aux indications actuelles
des thérapies hormonales substitutives (THS)?
Nos recommandations sont les mêmes que celles de la Société des obstétriciens et
gynécologues du Canada (SOGC), de l’American College of Obstetricians and
Gynecologists (ACOG), et de la U.S. Food and Drug Administration (FDA). Nous sommes
tous d’accord sur le principe directeur de la THS qui est d’utiliser la dose effective la
plus faible possible sur la plus courte période possible.
Comment déterminez-vous la dose la plus faible possible?
Évaluation : avec notre test BCB (Body Chemistry Balancing Test / test d’équilibre de la
biochimie du corps), nous évaluons les niveaux d’hormones, mais aussi une multitude
de facteurs biochimiques et nutritionnels qui influencent le bon fonctionnement des
hormones dans le corps de la femme. Cette évaluation nous permet de voir s’il y a un
besoin quelconque et quelles hormones peuvent être utiles. Souvent, on retrouve des
problèmes biochimiques sous-jacents qui peuvent provoquer les symptômes de la
ménopause comme une déficience en fer, un mauvais fonctionnement des glandes
surrénales et de la thyroïde, des problèmes digestifs, une déficience en magnésium ou
des déséquilibres neurochimiques. Une fois que ces problèmes sont identifiés, le
déséquilibre chimique peut être corrigé, et il est possible que la THS ne soit même pas
nécessaire.
Mode d’administration : notre foie détoxifie sélectivement toutes les substances que
nous consommons et qui pourraient avoir des propriétés toxiques. Lorsque les
hormones sont administrées par voie orale, cela s’appelle « l’effet de premier passage
au foie » et explique pourquoi de plus grandes doses sont nécessaires afin de
compenser pour cet effet de premier passage où les hormones sont métabolisées par le
foie (1). En revanche, lorsque les hormones sont administrées par la peau, cela évite cet
effet et des doses dix fois moins grandes que celles qu’on donnerait par voie orale sont
tout aussi efficaces. Il est donc possible de donner des doses plus faibles en
administrant les hormones par voie transcutanée.

Sélection des hormones : Il a été démontré que les hormones bio-identiques sont
efficaces pour une variété de symptômes associés à la ménopause. Avec les hormones
synthétiques, qui sont différentes et qui agissent très différemment des hormones bio-
identiques, des années de recherche ont été nécessaires pour établir les profils
toxicologiques, car quelque chose d’étranger était introduit dans le corps. Puisque la
biochimie des hormones humaines et leur fonctionnement dans le corps sont mieux
connus, les profils toxicologiques n’ont pas à être réévalués pour les hormones
naturelles. La clé pour réussir à trouver la plus faible dose d’hormones bio-identiques
efficace et sécuritaire est d’administrer les doses physiologiques (qui se rapprochent de
la quantité que le corps produirait lui-même). Lorsque vient le temps de choisir le type
d’hormone à utiliser, la progestérone en particulier, a démontré son efficacité pour
soulager plusieurs symptômes de la ménopause, incluant les bouffées de chaleur,
l’insomnie, l’anxiété et les troubles de l’humeur (2-5).
Quel est le produit le plus sécuritaire pour soulager la sécheresse vaginale?
Les oestrogènes administrés par voie transdermique ou vaginale ont une plus grande
biodisponibilité (plus de 10 fois supérieure) que ceux administrés par voie orale (6).
Il ne fait aucun doute que l’oestradiol utilisé intravaginalement chez les femmes en péri-
ménopause ou en ménopause, est très efficace pour soulager la sécheresse vaginale,
pour aider au contrôle de la vessie et pour soulager les autres problèmes reliés au
tractus urinaire.
Toutefois, des études contrôlées ont démontré que l’oestriol a aussi un taux de succès
assez important lorsqu’il est utilisé pour traiter la sécheresse vaginale, les infections
urinaires, les irritations vaginales et les problèmes de vessie et pour améliorer la santé
générale du vagin (7-14). Comme avantage additionnel, l’oestriol est un oestrogène plus
faible que l’oestradiol et a donc un moins grand impact sur l’activité oestrogénique
systémique.
Il a été rapporté que l’oestriol utilisé au niveau vaginal est sécuritaire pour l’endomètre
(15-17) et n’augmente pas le risque de cancer du sein (18-19).
La base dans laquelle on prépare les crèmes hormonales est très importante. Notre
produit Nutriplens a été conçu pour reproduire naturellement les sécrétions vaginales.
L’huile d’onagre, qui a démontré son efficacité pour soulager la sécheresse de la peau
(20-22), est utilisée comme phase huileuse dans Nutriplens. Une bonne base d’huile
d’onagre pour traiter la sécheresse permet d’utiliser une dose moins importante
d’oestriol et suit par conséquent le principe directeur qui est d’utiliser la dose efficace la
plus faible possible.

Quels sont les avantages de cette composition?
Si nous continuons de suivre le principe directeur qui est « d’utiliser la dose efficace la
plus faible possible sur la plus courte période possible », composer ou individualiser la
dose pour chaque personne est le moyen le plus simple et le plus sécuritaire pour
atteindre ce but. Tel que discuté dans l’exemple de la sécheresse vaginale, nous
pouvons ajuster la formule de base et la quantité d’hormones pour avoir la plus faible
dose efficace pour soulager les symptômes. Nous avons compris que l’approche de
« dose universelle » (même dose pour toutes les femmes) crée beaucoup de problèmes.
Une composition personnalisée selon les besoins individuels est donc une approche très
sécuritaire lorsqu’une femme a réellement besoin d’hormones.
Références
1. Sitruk-Ware, R. (2007) New hormonal therapies and regimens in the
postmenopause: routes of administration and timing of initiation. Climacteric 10: 358-
370.
2. Leonetti HB. et al. (1999) Transdermal progesterone cream for vasomotor symptoms
and postmenopausal bone loss. Obstet Gynecol 94(2):225-228.
3. Montplaisir J., et al. (2001) Sleep in menopause: Differential effects of two forms of
hormone replacement therapy. Menopause 8:6-10.
4. Cummings J., Brizedine, L. (2002) Comparison of physical and emotional side effects
of progesterone or medroxy progesterone in early postmenopausal women.
Menopause 9:253-263.
5. Fitzpatrick L., et al. (2000) Comparison of regimens containing oral micronized
progesterone or medroxyprogesterone acetate on quality of life in postmenopausal
women: a cross-sectional survey. J Womens Health Gend Based Med 9:381-387.
6. Head, K.A. (1998) Estriol: Safety and Efficacy. Alt Med Rev 3(2): 101-113.
7. Barentsen R, et al. (1997) Continuous low dose estradiol released from a vaginal ring
versus estriol vaginal cream for urogenital atrophy. Eur J Obstet Gynecol Reprod Biol
71:73-80.
8. Bottiglione F, et al. (1995) Transvaginal estriol administration in postmenopausal
women: A double-blind comparative study of two different doses. Maturitas 22:227-
232.
9. Casper F, Petri E. (1999) Local treatment of urogenital atrophy with an estradiol-
releasing vaginal ring: A comparative and a placebo-controlled multicenter study.
Vaginal Ring Study Group. Int Urogynecol J Pelvic Floor Dysfunct 10:171-6.
10. Dessole S., et al. (2004) Efficacy of low-dose intravaginal estriol on urogenital aging
in postmenopausal women. Menopause. 11(1):49-56.

11. Dugal R, et al. (2000) Comparison of usefulness of estradiol vaginal tablets and
estriol vagitories for treatment of vaginal atrophy. Acta Obstet Gynecol Scand 79:293-7.
12. Henriksson L, et al. (1994) A comparative multicenter study of the effects of
continuous low-dose estradiol released from a new vaginal ring versus estriol vaginal
pessaries in postmenopausal women with symptoms and signs of urogenital atrophy.
Am J Obstet Gynecol 171: 624-32.
13. Lose G, Englev E. (2000) Oestradiol-releasing vaginal ring versus oestriol vaginal
pessaries in the treatment of bothersome lower urinary tract symptoms. BJOG
107:1029.
14. Raz R, Stamm WE. (1993) A controlled trial of intravaginal estriol in postmenopausal
women with recurrent urinary tract infections. N Engl J Med 329:753.
15. Iosif, CS. (1992) Effects of protracted administration of estriol on the lower genito
urinary tract in postmenopausal women. Arch Gynecol Obstet. 251(3): 115-20.
16. Weiderpass, E. et al. (1999) Low-potency oestrogen and risk of endometrial cancer:
a case-control study. Lancet. 353(9167):1824-8.
17. Vooijs GP, Geurts TB. (1995) Review of the endometrial safety during intravaginal
treatment with estriol. Eur J Obstet Gynecol Reprod Biol. 62(1):101-6.
18. Rosenberg LU. et al. (2006) Menopausal hormone therapy and other breast cancer
risk factors in relation to the risk of different histological subtypes of breast cancer: A
case-control study. Breast Cancer Res 8:R11.
19. Lyytinen H, et al. (2006) Breast cancer risk in postmenopausal women using
estrogen-only therapy. Obstet Gynecol 108:1354.
20. Yoshimoto-Furuie, K., et al. (1999) Effects of oral supplementation with evening
primrose oil for six weeks on plasma essential fatty acids and uremic skin symptoms in
hemodialysis patients. Nephron 81(2):151-9.
21. Morse, P.F. et al. (1989) Meta-analysis of placebo-controlled studies of the efficacy
of Epogam in the treatment of atopic eczema. Relationship between plasma essential
fatty acid changes and clinical response. Br J Dermatol. 121(1):75-90.
22. Schalin-Karrila, M., et al. (1987) Evening primrose oil in the treatment of atopic
eczema: effect on clinical status, plasma phospholipid fatty acids and circulating blood
prostaglandins. Br J Dermatol. 117(1):11-9.
Source :
http://www.nutrichem.com/index.php?option=com_content&view=article&id=63:bio
-identical-hormonesfrequently-asked-questions&catid=18&Itemid=91
1
/
4
100%