Enquete sur les effets indesirables du tetrazepam

!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
Enquête!sur!les!effets!indésirables!du!tétrazépam!
!
Commission!nationale!de!pharmacovigilance,!20!novembre!2012!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
Centre!!régional!!de!!pharmacovigilance!!de!!Bordeaux!
!
!

!
"!
Résumé!
#$! %&%'()&*(+! $,%! -.$! /$.)012()&*2.$! (3(.%! -.$! 455! 1$*-2,! 6789:! 1(.,! ;$! <!%'(2%$+$.%! 1$,!
=0.%'(=%-'$,! +-,=-;(2'$,! 10-;0-'$-,$,! $.! '>-+(%0;0?2$! @$.! (,,0=2(%20.! (-A! %'(2%$+$.%,!
,*&=2B2C-$,D!EF! G;! .H$,%! *;-,! '$+/0-',&! *('! ;H(,,-'(.=$! +(;(12$! 1$*-2,! 1&=$+/'$! "I66! @J5K!
2.,-BB2,(.%DF!
#H$.C-L%$!*0'%$!,-'!;$,!$BB$%,!2.1&,2'(/;$,:!$.!*('%2=-;2$'!=-%(.&,F!
Méthodes)
4.(;3,$! 1$,! =(,! .0%2B2&,! 1(.,! ;(! /(,$! .(%20.(;$! 1$! *>('+(=0M2?2;(.=$:! 1$,! =(,! .0%2B2&,! (-A!
B(/'2=(.%,!N!10..&$,!1$!M$.%$!$%!1$!=0.,0++(%20.!N!10..&$,!1$!;(!;2%%&'(%-'$!
Résultats)
!"#$%&"'()&"*$%+$%,-"./"0)1(2(*"&0$%O!-.!%0%(;!1$!6868!=(,:!10.%!8PQ!?'(M$,!(!&%&!$.'$?2,%'&!N!;(!
+02%2&!1$!=$,!$BB$%,!,0.%!1$,!$BB$%,!=-%(.&,!@QIR!=(,:!10.%!SIR!?'(M$,DF!T('+2!$-A:!0.!'$%'0-M$!SS!
=(,!1$!,3.1'0+$!1$!J%$M$.,UV0>.,0.!@10.%!-.!=(,!1H&M0;-%20.!+0'%$;;$D:!SS!=(,!1$!,3.1'0+$!1$!
#3$;;!@10.%!7!=(,!1H&M0;-%20.!+0'%$;;$D:!R7!=(,!1H&'3%>W+$!*0;3+0'*>$!@10.%!-.!=(,!1H&M0;-%20.!
+0'%$;;$D:! 6R! =(,! 1$! ,3.1'0+$! 1H>3*$',$.,2/2;2%&! +&12=(+$.%$-,$! @XKYJJD! ! $%! S! (-%'$,! =(,!
*0,,2/;$,! 1$! XKYJJ:!R!=(,! 1$! *-,%-;0,$! $A(.%>&+(%2C-$! (2?-Z! ?&.&'(;2,&$!@-.! 8$! =(,!*0,,2/;$DF!
X$,! =(,! 1H(.(*>3;(A2$! 0.%! &?(;$+$.%! &%&! .0%2B2&,! @79! =(,! 1H-'%2=(2'$! U! (M$=! *('B02,! [1W+$!
*(;*&/'(;!0-!1$!;(!B(=$!(,,0=2&!U:!"6!=(,!1H[1W+$!1$!\-2.=]$!$%!6I!=(,!1H(.?2[1W+$D:!(-AC-$;,!2;!
B(-%! (^0-%$'! "! =(,! 1$! =>0=! (.(*>3;(=%2C-$! @J_`! <!4BB$=%20.,! 1-! ,3,%W+$! 2++-.2%(2'$!EDF! X$!
.0+/'$-A!=(,!1H>3*$',$.,2/2;2%&!'$%('1&$!0.%!&?(;$+$.%!&%&!.0%2B2&,:!10.%!98!=(,!(M$=!*(%=>!%$,%!
(-! %&%'()&*(+! *0,2%2B!N! 8! =(,! 1H$A*0,2%20.! *'0B$,,20..$;;$! 1H>3*$',$.,2/2;2%&! '$%('1&$! 0.%! &%&!
.0%2B2&,[email protected]+/'$-A!=(,!1(.,!;(!;2%%&'(%-'$DF!
T('+2!;$,!$BB$%,!?'(M$,!(-%'$,!C-$!=-%(.&,:!;$,!$BB$%,!.$-'0;0?2C-$,:!;$,!$BB$%,!*,3=>2(%'2C-$,!$%!
;$,!%'0-/;$,!?&.&'(-A!'$*'&,$.%$.%!-.$!*('%!2+*0'%(.%$F!
X(.,!;(!*;-*('%!1$,!=(,!.0%2B2&,:!;(!*0;3+&12=(%20.!$,%!+(^0'2%(2'$!@(,,0=2(%20.!a!1$,!(.%(;?2C-$,:!
a!1$,!(.%2U2.B;(++(%02'$,!.0.!,%&'0b12$.,:!a!1$,!+30'$;(A(.%,:!$'03DF!
4"./(% *$#% 0"#% 2."1$#% +$#% *"5)."')(.$#! @10-/;0.,! 1$! ;(! /(,$! $A=;-,D:! 0.! '$%'0-M$! 9! =(,! 1$!
,3.1'0+$! 1$! #3$;;! 10.%! "! 1H&M0;-%20.! +0'%$;;$:! P! =(,! 1$! ,3.1'0+$! 1H>3*$',$.,2/2;2%&!
+&12=(+$.%$-,$! @XKYJJD:! P! =(,! 1H&'3%>W+$! *0;3+0'*>$:! 6! =(,! 1$! J%$M$.,UV0>.,0.:! 6!
M(,=-;('2%$! ;$-=0=3%0=;(,2C-$:! 6! 1$'+(%0,$! /-;;$-,$:! ! Q! =(,! 1H&'-*%20.,! 12M$',$,F! 4! .0%$'!
&?(;$+$.%!R!,-2=21$,!$%!R!%$.%(%2M$,!1$!,-2=21$F!
#$!%&%'()&*(+!B(2%!*('%2$!1$,!/$.)012()&*2.$,!;$,!*;-,!-%2;2,&$,!$.!c'(.=$!@6$'!'(.?! $.!.0+/'$!
1$! +(;(1$,! *'&M(;$.%,! $.! "II7! $%! "I6I! 1H(*'W,! ;$,! 10..&$,! 1-! '&?2+$! ?&.&'(;! 1$! ;H(,,-'(.=$!
+(;(12$D:!+L+$!,2!=$!.H$,%!*(,!%0-^0-',!,-'!-.!+01$!=0.%2.-:!(M$=!1$,!=>2BB'$,!$.!(-?+$.%(%20.!
,-'!;(!*&'201$!"IIRU"I6IF!
`$,!10..&$,! ,0.%!=0.B0'%&$,!*('! ;$,!10..&$,! 1$! ;(! ;2%%&'(%-'$:!0d!;$,!*-/;2=(%20.,!1$!=(,!0-! 1$!
,&'2$,!1$!=(,!1H$BB$%,!=-%(.&,!*'&10+2.$.%F!
Conclusion)
`$!/2;(.!+0.%'$!-.!%'0*2,+$!=-%(.&!2.>(/2%-$;!(-!,$2.!1$!;(!=;(,,$!1$,!/$.)012()&*2.$,:!$.!*;-,!
1$,! $BB$%,! =;(,,2C-$,! 1$,! /$.)012()&*2.$,F! #$! 1&'$+/0-',$+$.%! .H$,%! *(,! ,-BB2,(.%! *0-'!
12+2.-$'! ;$! '2,C-$:! =0+*%$! %$.-! 1-! B(2/;$! *'2A! 1$! %0-%$,! ;$,! /$.)012()&*2.$,F! T('! (2;;$-',:! ;$!
%&%'()&*(+! '$,%$! (-^0-'1H>-2! ;(! ,$-;$! /$.)012()&*2.$! ,-'! ;$! +('=>&! B'(.e(2,! 10.%! ;(! 1-'&$! 1$!
*'$,='2*%20.!.H$,%!*(,!;2+2%&$F!!

!
S!
#0',! 1$! ;(! *'&*('(%20.! 1H-.! =(,! +('C-(.%! *0-'! ;$! `0+2%&! %$=>.2C-$! 1$! ^-2.! "I66:! a!
*'0*0,! 1H-.! =(,! 1H$=)&+(! (-! %&%'()&*(+! =>$)! -.$! 2.B2'+2W'$! @$A*0,2%20.!
*'0B$,,20..$;;$D ;a/(,$!
.(%20.(;$! 1$! *>('+(=0M2?2;(.=$! (M(2%! &%&! =0.,-;%&$! $%! -.$! '$=>$'=>$! '(*21$! 1(.,! ;(!
;2%%&'(%-'$! (M(2%! &%&! B(2%$! @*;-,2$-',! =(,! *-/;2&,! 1H$BB$%,! =-%(.&,:! .0%(++$.%! ;0',!
1H$A*0,2%20.!*'0B$,,20..$;;$DF!X$M(.%!;$!.0+/'$!1$!=(,:!;H4?$.=$!(M(2%!1&=21&!-.$!+2,$!
$.!$.C-L%$!*0'%(.%!,-'!;$,!$BB$%,!2.1&,2'(/;$,!1-!%&%'()&*(+F!
!
1.!Rappels!
#$! %&%'()&*(+! $,%! -.$! /$.)012()&*2.$! 10.%! ;H2.12=(%20.! $,%!O! <!g'(2%$+$.%! 1$,!
=0.%'(=%-'$,!+-,=-;(2'$,!10-;0-'$-,$,!$.!'>-+(%0;0?2$!@$.!(,,0=2(%20.!(-A!%'(2%$+$.%,!
,*&=2B2C-$,D!EF!
K&,$'M&! a! ;H(1-;%$:! ;(! *0,0;0?2$! '$=0++(.1&$! M('2$! 1$! "R! +?! @*0,0;0?2$! *0-'!
=0++$.=$'! =>$)! ;$! ,-^$%! h?&:! 2.,-BB2,(.%! '&.(;:! 2.,-BB2,(.%! >&*(%2C-$D! a! 6RI! +?i"P! >!
@+(;(1$! >0,*2%(;2,&! 0-! (;2%&D! ,$;0.! ;$! =0.%$A%$! =;2.2C-$:! (M$=! -.$! *0,0;0?2$! +03$..$!
>(/2%-$;;$!1$!6II!+?i"P>F!#$!%&%'()&*(+!$,%!2.,='2%!,-'!#2,%$!GF!
Médicaments)ayant)une)AMM)et)médicaments)commercialisés))
J*&=2(;2%&! *'2.=$*,!O! 530;(,%(.j:! =0++$'=2(;2,&! $.! c'(.=$! 1$*-2,! 679Q! @(=%-$;;$+$.%!
=0++$'=2(;2,&!1(.,!SQ!*(3,DF!
T'&,$.%(%20.!O!=0+*'2+&!*$;;2=-;&!,&=(/;$!a!RI!+?!@a!(M(;$'!,(.,!='0C-$'D!
X2A!,$*%!,*&=2(;2%&,!0.%!0-!0.%!$-!-.$!455!$%!6"!,0.%!=0++$'=2(;2,&$,F!
!
Nom!! Laboratoire! Date!AMM!
Mégavix®! Sanofi! 07/11/1994!
(archivée!;! arrêt! commercialisation! juillet!
2005)!
Myolastan®!(princeps)!
Sanofi!!
03/05/1967!
Panos®!
Daiichi!Sankyo!France!
21/12/1994!
Tétrazépam!Almus1!
Almus!
05/05/2003!
Tétrazépam!Arrow1!!
Arrow!(titulaire,!AMM!;!!Almus!
(exploitant)!
17/07/2001!
Tétrazépam!Biogaran!!
Biogaran!
20/10/1999!
Tétrazépam!Cristers!
Cristers!
26/07/2000!
Tétrazépam!EG!
EG!Labo!(Eurogenerics)!
02/07/2001!
Tétrazépam!G!Gam!
Sandoz!
26/07/2000!
(archivée!;! arrêt! commercialisation!
septembre!2006!bte!20,!juillet!2006!bte!50)!
Tétrazépam!Mylan!
Mylan!SAS!
12/02/1998!
Tétrazépam!Qualimed!
Qualimed!
03/07/2001!
Tétrazépam!Ratiopharm2!!
Ratiopharm!
28/12/1999!
Tétrazépam!RPG!
Ranbaxy!
26/07/2000!!
Tétrazépam!Sandoz!
Sandoz!!
22/12/1999!
Tétrazépam!Teva2!
Teva!Santé!
03/05/2000!
Tétrazépam!Zentiva3!!
Sanofi!!
11/06/2003!
Tétrazépam!Zydus!
Zydus!
11/02/!2000!
Tableau!I.!AMM!de!tétrazépam!en!France!
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!

!
P!
Pharmacologie)
4g`!O!4-%'$,!+&12=(+$.%,!a!(=%20.!=$.%'(;$:!5ISfkI9!
YBB$%,!*>('+(=0;0?2C-$,!21$.%2C-$,!a!=$-A!1$!%0-%$,!;$,!/$.)012()&*2.$,!O!+30'$;(A(.%:!
(.A20;3%2C-$:!,&1(%2B:!>3*.0%2C-$:!(.%2=0.M-;,2M(.%:!(+.&,2(.%!
Mentions)sur)le)risque)
U!`0++$!;$,!/$.)012()&*2.$,!(.A20;3%2C-$,:!2;!$,%!=;(,,&!$.!.2M$(-!"!*0-'!;(!=0.1-2%$!
(-%0+0/2;$!@*2=%0?'(++$!0'(.?$F!J03$)!%'W,!*'-1$.%F!l$!*(,!=0.1-2'$!,(.,!;H(M2,!1H-.!
*'0B$,,20..$;! 1$! ,(.%&DF! 5(;>$-'$-,$+$.%:! =0++$! *0-'! %0-,! ;$,! +&12=(+$.%,!
=0+*0'%(.%!-.!'2,C-$!*0-'!;(!=0.1-2%$!(-%0+0/2;$:!=$%%$!+$.%20.!C-2!B2?-'$!,-'!;(!/0m%$!
.H$,%!*(,!1(.,!;$!'&,-+&!1$,!=('(=%&'2,%2C-$,!1-!*'01-2%:!=$!C-2!.H2.=2%$!*(,!;$!+&1$=2.!a!
2.B0'+$'!=0''$=%$+$.%!;$!+(;(1$!,-'!=$!'2,C-$F!
U! #(! '-/'2C-$! 52,$,! $.! ?('1$! $%! *'&=(-%20.,! 1H$+*;02! $,%! =$;;$! 1$,! /$.)012()&*2.$,!
(.A20;3%2C-$,!
U! K-/'2C-$! G.%$'(=%20.,!O! ;H(,,0=2(%20.! a! ;H(;=00;! $,%! 1&=0.,$2;;&$!N! (-! .2M$(-! 1$,!
<!2.%$'(=%20.,! a! *'$.1'$! $.! =0+*%$!E:! ;$,! <!(-%'$,! +&12=(+$.%,! ,&1(%2B,!E! ,0.%!
+$.%20..&,:! .0%(++$.%! ;$,! <!1&'2M&,! +0'*>2.2C-$,!E:! %'W,! ,0-M$.%! =0U*'$,='2%,! $.!
*'(%2C-$F!
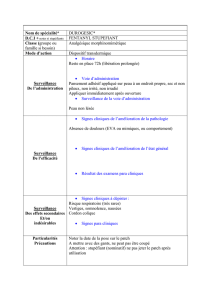
U!K-/'2C-$!YBB$%,!2.1&,2'(/;$,:!*0-'!;$,!$BB$%,!=-%(.&,:!,0.%!(=%-$;;$+$.%!+$.%20..&,!O!
$=)&+(! 1$! =0.%(=%:! &'-*%20.! +(=-;0U*(*-;$-,$! ! *'-'2?2.$-,$:! ! &'3%>W+$! *0;3+0'*>$:!
,3.1'0+$!1$!J%$M$.,UV0>.,0.:!,3.1'0+$!1$!#3$;;F!T0-'!;$!530;(,%(.j:!;$!;(/0'(%02'$!(!
1&*0,&! -.$! 1$+(.1$! 1$! +012B2=(%20.! 1$! ;H2.B0'+(%20.! *0-'! (^0-%$'! ,3.1'0+$!
1H>3*$',$.,2/2;2%&! +&12=(+$.%$-,$! @XKYJJD! @(M2,! B(M0'(/;$DF! #$,! '(**0'%$-',! 0.%!
*'0*0,&!1H(^0-%$'!&?(;$+$.%!*-,%-;0,$!$A(.%>&+(%2C-$!(2?-Z!?&.&'(;2,&$F!
Avis)de)la)Haute)Autorité)de)Santé)
U!J5K!2.,-BB2,(.%!@(M2,!1$!;(!`0++2,,20.!1$!;(!%'(.,*('$.=$!1-!69!.0M$+/'$!"I6I!$%!1-!
"9!(M'2;!"I66D!
U!/(2,,$!1-!'$+/0-',$+$.%!a!6R!n!$.!(M'2;!"I6I!
U!<!1&'$+/0-',$+$.%!E!!a!*('%2'!1-!6$'!1&=$+/'$!"I66!
!
2.!Données!de!notification!spontanée!
!2.1.!Méthode!
U!`(,!1$,!=$.%'$,!'&?20.(-A!O!1$+(.1$!a!;H4?$.=$!1H-.$!$A%'(=%20.!1$,!=(,!1$!;(!/(,$!
.(%20.(;$!1$!*>('+(=0M2?2;(.=$!.0%2B2&,!^-,C-H(-!SIiI8i"I6"F!!
#H(.(;3,$!(!&%&!B(2%$!,-'!;$!*'$+2$'!$BB$%!2.1&,2'(/;$!=01&:!C-2!$,%!?&.&'(;$+$.%!;H$BB$%!
2.1&,2'(/;$! *'2.=2*(;F! `$*$.1(.%:! *0-'! ;$,! $BB$%,! =-%(.&,:! C-2! '$*'&,$.%$.%! *'W,! 1$! ;(!
+02%2&!1$!;H$.,$+/;$!1$,!$BB$%,! 2.1&,2'(/;$,! .0%2B2&,:!!;$,!$BB$%,!$.!"$!$%!S$!*0,2%20.! 0.%!
&?(;$+$.%! &%&! *'2,! $.! =0+*%$:! (2.,2! C-$! =$-A! C-2:! 1(.,! 5$1XK4:! ,0.%! =;(,,&,! 1(.,!
1H(-%'$,!=;(,,$,!,3,%W+$,!0'?(.$,!@J_`D:!.0%(++$.%!;$,!&'-*%20.,!*-,%-;$-,$,!C-2!,0.%!
1(.,!;$!J_`!G.B$=%20.,!$%!2.B$,%(%20.,F!
#H(.(;3,$!*0'%$!*'2.=2*(;$+$.%!,-'!;$,!$BB$%,!2.1&,2'(/;$,!=-%(.&,!$%!;$,!$BB$%,!?'(M$,F!!
Y.! '(2,0.! 1$! ;(! *&'201$! 1H&%-1$! @1$*-2,! ;(! =0++$'=2(;2,(%20.D! $%! 1$,! =>(.?$+$.%,!
,-'M$.-,! 1(.,! ;(! ,%'-=%-'$! 1$! ;(! /(,$! .(%20.(;$! @%'(.,=01(?$! 1$,! =(,! ;$,! *;-,! (.=2$.,:!
+012B2=(%20.,!1$,!M('2(/;$,!$%!1$,!'$=0++(.1(%20.,!1$!=01(?$D:!;H(.(;3,$!1$,!M('2(/;$,!
=01&$,!(!&%&! =0+*;&%&$!*('!-.$!'$=>$'=>$!%$A%-$;;$:!.0%(++$.%!*0-'!;$,!=(,! ?'(M$,!$%!

! R!
;$,! $BB$%,! =-%(.&,! @'$=>$'=>$! 1$,! 1&=W,! *('! ;(! ?'(M2%&:! ;H&M0;-%20.! 1$! ;H$BB$%! $%! 1(.,! ;$!
%$A%$!N! '$=>$'=>$! %$A%-$;;$! 1$,! $A*0,2%20.,! *'0B$,,20..$;;$,!N! '$=>$'=>$! %$A%-$;;$! 1$,!
XKYJJ!N!'$=>$'=>$!%$A%-$;;$!1$,!%$,%,!(;;$'?0;0?2C-$,!N!$'03!D!
X$*-2,!;(! '&-.20.! 1-! =0+2%&!%$=>.2C-$! 1$! *>('+(=0M2?2;(.=$! 1-!8! .0M$+/'$! "I6":!
=0.B0'+&+$.%!a!;(!12,=-,,20.!;0',!1$!;(!*'&,$.%(%20.!1-!10,,2$':!*;-,2$-',!&;&+$.%,!0.%!
&%&!*'&=2,&,!O!!
U!*0-'!;$,!(%%$2.%$,!=-%(.&$,!;$,!*;-,!?'(M$,!@,3.1'0+$!1$!#3$;;:!,3.1'0+$!1$!J%$M$.,U
V0>.,0.:! >3*$',$.,2/2;2%&! +&12=(+$.%$-,$! 0-! XKYJJD!O! *'&=2,20.,! ,-'! ;$! 1&;(2! 1$!
,-'M$.-$!N!.(%-'$!1$,!+&12=(+$.%,!,-,*$=%,!*'2,!,2+-;%(.&+$.%!N!.0+/'$!1$!=(,!0d!;$!
%&%'()&*(+! $,%! ;$! ,$-;! ,-,*$=%! 0-! (M$=! -.! ,=0'$! 1H2+*-%(/2;2%&! ,-*&'2$-'! a! =$;-2! 1$,!
+&12=(+$.%,! (,,0=2&,F! #(! '$=>$'=>$! (! &%&! =0+*;&%&$! *0-'! ;$,! XKYJJ! @;$! %$'+$! .$!
*0-M(.%! L%'$! =01&! 1(.,! ;(! /(,$! .(%20.(;$! C-$! 1$*-2,! ^-2.! "II9:! 1(%$! 1H(10*%20.! 1$! ;(!
=;(,,2B2=(%20.!5$1XK4D:!$.!M&'2B2(.%!%0-,!;$,!=(,!?'(M$,!1H&'-*%20.!(M$=!1$,!%$'+$,!=01&,!
*0-M(.%!&M0C-$'!-.!XKYJJ!@>3*$'&0,2.0*>2;2$:!(%%$2.%$!>&*(%2C-$:!(%%$2.%$!'&.(;$:!$'0363%
g0-,! ;$,! =(,! ?'(M$,! =01&,! 7.8'-9/$% ,)*8/).,-$%! 0-! 7.8'-9/$% /:*'(;)./$% 2."1$% 0-!
7.:,'()&%5:**$:#$%0.%!&%&!'$M-,!(2.,2!C-$!;$,!=(,!1H(%%$2.%$!=-%(.&$!?'(M$!(M$=!(-!+02.,!
-.$!(-%'$!(%%$2.%$!,3,%&+2C-$!*0-'!,H(,,-'$'!C-H2;!.H3!(M(2%!*(,!$-!1H&M0;-%20.!M$',!-.$!
B0'+$! 1$! %0A21$'+2$! *;-,! ?'(M$! 0-! -.! XKYJJF! @#$,! 2.12=(%20.,! 0.%! &?(;$+$.%! &%&!
(.(;3,&$,!*0-'!=$,!=(,FD!
U!%$,%,!(;;$'?0;0?2C-$,!O!%(-A!1$!*0,2%2M2%&!N!!.(%-'$!1$,!$BB$%,!2.1&,2'(/;$,!*0-'!;$,!=(,!
(M$=!*(%=>!%$,%!*0,2%2BF!@#(!'$=>$'=>$!%$A%-$;;$!C-2!(M(2%!&%&!B(2%$!(M$=!<!*(%=>!E:!<!*'2=]E:!
<!GXK!E!<!%$,%!E!(!&%&!=0+*;&%&$!*('!-.$!'$=>$'=>$!(M$=!<!(;;$'?0!EFD!
F! ;$,! 10..&$,! K$?2,=('! 0.%! &%&! 1$+(.1&$,:! +(2,! .$! ,$'0.%! *'0/(/;$+$.%! *(,!
12,*0.2/;$,!(M(.%!*;-,2$-',!,$+(2.$,!0-!+02,!
U!;$!.0+/'$!1$!+(;(1$,!%'(2%&,!(-!=0-',!1$,!R!1$'.2W'$,!(..&$,!@+(;(1$,!*'&M(;$.%,!
$%! +(;(1$,! 2.=21$.%,D!N! *0,0;0?2$,! +03$..$! $%! +&12(.$!N! =0U*'$,='2*%20.,:! .0%(++$.%!
1H4GlJ!N! 1-'&$,! 1$! %'(2%$+$.%! @+03$..$:! +&12(.$:! $A%'L+$,D! (-! =0-',! 1H-.$! (..&$!
@10..&$,!1$+(.1&$,:!'&*0.,$!$.!(%%$.%$D!!
U! ;H$,%2+(%20.! 1H-.! %(-A! 1$! .0%2B2=(%20.! *0-'! ;H$.,$+/;$! 1$,! $BB$%,! ?'(M$,:! 1$,! $BB$%,!
=-%(.&,! ?'(M$,! $%! 1$,! $BB$%,! =-%(.&,! ;$,! *;-,! ?'(M$,! .$! *0-''(! L%'$! B(2%$! C-H(M$=! ;$,!
10..&$,!*'&=&1$.%$,!
U! `(,! 1$,! ;(/0'(%02'$,!O! 1$+(.1$! (-A! ;(/0'(%02'$,! 1$,! =(,! B'(.e(2,! @B2=>$,! `G_5J:!
TJoKDF! _.%! &%&! $A=;-,!O! ;$,! 10-/;0.,! @=(,! 1$,! =$.%'$,! '&U$.'$?2,%'&,! 1(.,! ;$,! /(,$,! 1$!
10..&$,!1$,!2.1-,%'2$;,D:!;$,!=(,!1$!;(!;2%%&'(%-'$:!;$,!=(,!*'0M$.(.%!1H$,,(2,!0-!1H&%-1$,F!
`0+*%$!%$.-!1$!;(!12BB2=-;%&!a!21$.%2B2$'!;$,!10-/;0.,!1$,!12BB&'$.%,!;(/0'(%02'$,!@=(,!
1$,! =$.%'$,! a! .0-M$(-! ,(2,2,! 1(.,! ;$,! /(,$,! 1$! 10..&$,! 1$,! 2.1-,%'2$;,:! =(,! 1$! ;(!
;2%%&'(%-'$:! =(,! 1$,! $,,(2,! =;2.2C-$,! 0-! 1$,! &%-1$,:! $'03D:! ;H(.(;3,$! (! &%&! *'2.=2*(;$+$.%!
B(2%$! ,-'! ;$,! =(,! 1$! ;(! /(,$! .(%20.(;$F! #$,! =(,! ?'(M$,! 1$,! ;(/0'(%02'$,:! 10-/;0.,! $A=;-,!
C-(.1!2;,!0.%!*-!L%'$!21$.%2B2&,:!0.%!&%&!(.(;3,&,!$.!=0+*;&+$.%F!
2.2.!Résultats!
f(,$!.(%20.(;$!O!"SQ"!=(,!$.'$?2,%'&,!(M$=!<!%&%'()&*(+!E!N!*('+2!$-A:!6869!=(,!(M(2$.%!
-.!=01$!_5J!<!,-,*$=%!E!0-!<!2.%$'(=%20.!EF!4*'W,!$A=;-,20.!1H-.!10-/;0.: !6868!=(,!0.%!
&%&!'$%$.-,!*0-'!;H(.(;3,$F!
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
!
!!
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%