Brèves de pharmacovigilance

DOI : 10.1684/med.2013.0941
THÉRAPEUTIQUES
Michel Gerson
Centre hospitalier
de Colmar
Brèves de pharmacovigilance
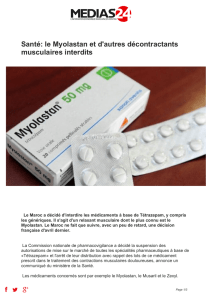
Tétrazépam : un risque
cutané inacceptable
Le tétrazépam (Myolastan®, Panos®et génériques) est
une benzodiazépine indiquée dans le « traitement des
contractures musculaires douloureuses en rhumatolo-
gie (en association aux traitements spécifiques) ».
SMR insuffisant...
Dès 1999, la Commission de la Transparence avait cré-
dité le tétrazépam d’un service médical rendu faible.
Elle l’avait qualifié d’insuffisant en 2005 [1]. Ce même
avis avait été renouvelé en 2010 avec une proposition
de déremboursement [2]. Il y était noté que « le rap-
port efficacité/effets indésirables de Myolastan®[était]
défavorable ». Les spécialités à base de tétrazépam
ont été effectivement déremboursées en décembre
2011.
C’est aussi en 2011 que l’ANSM a décidé l’ouverture
d’une enquête officielle de pharmacovigilance confiée
au Centre régional de pharmacovigilance (CRPV) de
Bordeaux et présentée le 20 novembre à la Commis-
sion nationale de pharmacovigilance (CNPV) [3, 4].
Cette enquête a analysé les 1 616 notifications d’ef-
fets indésirables colligés depuis la mise sur le marché.
Les affections cutanées représentent la moitié des
cas notifiés : 827, dont 310 graves. Il s’y ajoute 72 cas
dont 35 effets cutanés transmis par 3 laboratoires.
Effets indésirables notifiés
Comme avec les autres benzodiazépines, des effets
neuropsychiques (coma, somnolence, convulsions,
confusion, désorientation) ont été notifiés. Mais ce qui
distingue le tétrazépam des autres benzodiazépines
est le nombre élevé d’effets indésirables cutanés.
Effets indésirables cutanés parfois
d'évolution mortelle
Au total, parmi les toxidermies graves, l’équipe borde-
laise a dénombré 40 syndromes de Lyell dont 11
d’évolution mortelle, 34 cas de syndrome de Stevens-
Johnson dont un d’évolution mortelle, 63 cas d’éry-
thème polymorphe dont un d’évolution mortelle, 5 cas
de pustulose exanthématique aiguë généralisée et
19 cas de DRESS (voir ci-dessous). Il a aussi été ob-
servé 118 cas d’urticaire dont 21 sévères avec
œdème de Quincke et 19 cas d’angiœdème. Les au-
tres effets cutanés sont souvent des éruptions de ty-
pes variés : maculopapuleuse le plus souvent, et aussi
vésiculeuse, pustuleuse, purpurique ou bulleuse. Il
s’agit vraisemblablement d’un mécanisme d’hyper-
sensibilité retardée de type IV comme le montrent des
patch-tests positifs.
Six professionnels de santé (5 infirmiers et une aide-
soignante) ont souffert de lésions cutanées rythmées
par la vie professionnelle. Il s’agissait de lésions
diverses parfois eczématiformes touchant les mains
et parfois le visage et les avant-bras. Ces soignants
manipulaient des comprimés de tétrazépam : section,
broyage au mortier pour administration à des sujets
ayant des difficultés à avaler. Dans les 6 cas, le patch-
test a été positif pour le tétrazépam.
L’enquête officielle a identifié 115 cas ayant eu un bi-
lan allergologique. Il y a eu 69 % de tests positifs au
tétrazépam dont 58 % exclusivement positifs avec
cette benzodiazépine.
Le rapporteur devant la CNPV a conclu
à un risque inacceptable
Il a proposé à la CNPV une suspension de l’AMM et
a été suivi par la majorité de la Commission, mais pas
par l’ANSM, qui a seulement demandé un arbitrage
au Comité européen de pharmacovigilance. Dans d’au-
tres dossiers plus médiatisés, l’ANSM a pourtant su
procéder à une suspension d’AMM. Deux poids, deux
mesures selon que le dossier fait ou non la Une des
médias grand public ?
Mots clés : benzodiazépines, toxidermies [Benzodia-
zepines; Drug Eruptions]
Références :
1. Myolastan 50 mg. Commission de la transparence. Avis du 14 décembre
2005. www.has-sante.fr
2. Myolastan 50 mg. Commission de la transparence. Avis du 17 novembre
2010. www.has-sante.fr
3. Enquête sur les effets indésirables du tétrazépam. CRPV Bordeaux.
11/01/2013. Sur www.ansm.sante.fr
4. Extrait de la CNPV du 20/11/2012. Enquête sur les effets indésirables du
tétrazépam. Sur www.ansm.sante.fr
Le syndrome
d'hypersensibilité
médicamenteuse ou DRESS
Le syndrome d’hypersensibilité médicamenteuse ou
DRESS (Drug Reaction with Eosinophilia and Systemic
Symptom) est un effet indésirable grave d’individuali-
sation récente puisque cet acronyme a été introduit en
1996. Une équipe française a analysé les 172 cas
qu’elle a identifiés dans la littérature de 1997 à 2009 [1].
Le DRESS est un effet indésirable parfois mortel qui
associe une éruption cutanée sévère, de la fièvre, des
anomalies hématologiques (éosinophilie ou lymphocy-
tes atypiques) et des atteintes de divers organes. L’at-
teinte la plus fréquente est celle du foie avec élévation
des enzymes hépatiques ou hépatomégalie. Des at-
teintes rénales, pulmonaires ou myocardiques ont
également été observées. Un mécanisme de réacti-
vation virale a été suggéré.
La mortalité est de l’ordre de 10 %.
La survenue du DRESS est retardée de 2 à 6 semai-
nes après l’introduction du médicament responsable.
Le DRESS peut s’aggraver malgré l’arrêt de ce médi-
cament. En présence de signes de gravité, une corti-
cothérapie est indiquée.
114 MÉDECINE mars 2013
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Au total, 44 médicaments ont été impliqués dans ces
172 cas : antiépileptiques (1/3 des cas : carbamazépine, la-
motrigine et phénobarbital), puis allopurinol et sulfasala-
zine. L’analyse de 312 notifications de DRESS de la Base
nationale de pharmacovigilance recoupe en partie cette
liste avec l’ordre décroissant suivant : sulfasalazine, allopu-
rinol, minocycline, ranélate de strontium, colchicine, lamo-
trigine et cotrimoxazole [2]. La liste des médicaments res-
ponsables n’est pas close et s’enrichit régulièrement
(parmi les plus récemment concernés, l’étifoxine et la si-
tagliptine) [3].
Mots clés : toxicité des médicaments, toxidermies [Drug
Toxicity; Drug Eruptions]
Références :
1. Cacoub P, Musette P, Descamps V, Meyer O, Speirs C, Finzi L, et al. The DRESS
syndrome: a literature review. Am J Med. 2011;124:588-97.
2. Montastruc JL. Quels médicaments à l’origine du DRESS syndrome ? BIP 31.
2012;19(1):10. Sur www.bip31.fr
3. Sin C, Mahé E, Sigal M-L. Drug reaction with eosinophilia and systemic symptoms
(DRESS) in a patient taking sitagliptin. Diabetes & Metabolism. 2012;38:571-3.
Étifoxine : des atteintes
cutanées et hépatiques
L’étifoxine (Stresam®) est un anxiolytique de la famille des
benzoxazines indiqué dans les « manifestations psychoso-
matiques de l’anxiété telles que dystonies neurovégétatives,
notamment à expression cardiovasculaire ».
La CNPV a analysé 419 effets indésirables notifiés de 2000
à 2012 [1]. Plus de la moitié sont des effets cutanés avec
des cas de toxidermies sévères, notamment : 5 DRESS (dans
2 cas, l’étifoxine était le seul médicament suspect), 10 toxi-
dermies bulleuses à type d’érythème polymorphe et 5 syn-
dromes de Stevens-Johnson. Sept cas de vascularite ont été
observés avec un délai médian évocateur de 10 jours après
le début de traitement.
Les atteintes hépatiques (29 cas) étaient en majorité des at-
teintes aiguës cytolytiques, parfois sévères, apparaissant
dans un délai inférieur à 2 mois après l’introduction de l’éti-
foxine ; dans 25 cas, la responsabilité de l’étifoxine a été re-
tenue dont un cas avec réadministration positive.
Des notifications suggèrent la possibilité d’interactions mé-
dicamenteuses avec :
– les AVK (diminution de l’INR chez 4 patients) ;
– les contraceptifs oraux (16 cas de métrorragies dont
5 réadministrations positives et diminution de l’efficacité
contraceptive avec 4 cas de grossesse).
La CNPV a demandé à l’unanimité le 26 juin 2012 que ces
effets indésirables soient désormais mentionnés dans le
RCP. Consulté le 18 février 20131, le RCP ne mentionnait
pas ces effets indésirables.
Au-delà de l’inertie administrative propre à l’ANSM, ces ef-
fets indésirables amènent à s’interroger sur le rapport béné-
fice/risque de cet anxiolytique, sachant que la Commission
de la Transparence de la HAS l’a crédité d’un service médical
rendu faible en 2011 [2].
Mots clés : lésions hépatiques chroniques dues aux médica-
ments, toxicité des médicaments, toxidermies [Drug toxicity;
Drug Eruptions; Drug-Induced Liver Injury, chronic]
Références :
1. Réévaluation du rapport bénéfice/risque de Stresam (efitoxine) : bilan des données de
sécurité d’emploi (2000-2012). www.ansm.sante.fr
2. Stresam gélules. Commission de la transparence. Avis du 14 décembre 2011. Sur
www.has-sante.fr
Zolpidem : attention
à la conduite automobile
au réveil...
De nouvelles études de pharmacologie clinique avec simula-
teur de conduite ont été soumises à la FDA montrant que
des taux sériques supérieurs à 50 ng/mL sont de nature à
altérer la conduite automobile au point d’accroître le risque
d’accident [1]. Les études pharmacocinétiques incluant envi-
ron 250 hommes et 250 femmes ont montré qu’environ
15 % des femmes et 3 % des hommes avaient des taux
sériques supérieurs à 50 ng/mL 8 heures après la prise de
10 mg de zolpidem. Le 10 janvier dernier, la FDA a donc pu-
blié une recommandation sur la posologie du zolpidem (Stil-
nox®et génériques) chez la femme, en baissant la dose ini-
tiale de zolpidem de 10 à 5 mg.
Rappelons que l’efficacité clinique du zolpidem est modé-
rée : pour les 3 hypnotiques non benzodiazépine (eszopi-
clone, zaleplon et zolpidem), une méta-analyse récente des
études soumises à la FDA montre un gain modeste pour le
délai d’endormissement par rapport au placebo et l’absence
de bénéfice pour d’autres critères comme la qualité du som-
meil et le nombre de réveils nocturnes [2].
Mots clés : conduite automobile, toxicité des médicaments
[Automobile Driving; Drug Toxicity]
Références :
1. Risk of next-morning impairment after use of insomnia drugs. FDA requires lower re-
commended doses for certain drugs containing zolpidem. 10/1/2013. Sur www.fda.gov
2. Huedo-Medina TB, Kirsch I, Middlemass J, Klonizakis M, Siriwardena AN. Effectiveness
of non-benzodiazepine hypnotics in treatment of adult insomnia : meta-analysis of data
submitted to the Food and Drug Administration. BMJ. 2013;345:e8343.
1. Vidal Pro électronique.
115mars 2013MÉDECINE
THÉRAPEUTIQUES
Brèves de pharmacovigilance
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.
1
/
2
100%