Documents de Physique-Chimie – M. MORIN 1 Thème : Synthétiser

Documents de Physique-Chimie – M. MORIN
1
Thème : Synthétiser des molécules
Partie : Stratégie de synthèse
Cours 23 : Réactif chimiosélectif-Protection de fonctions.
En plus des paramètres vus dans le cours précédents, la stratégie d’une synthèse organique peut avoir recours à des
espèces chimiques permettant de réaliser des transformations chimiques sur certains groupements d’une molécule
et pas d’autres.
I. Réactif chimiosélectif.
1. Définition.
Un réactif est dit « chimiosélectif » s’il réagit seulement avec un groupement fonctionnel parmi
plusieurs autres.
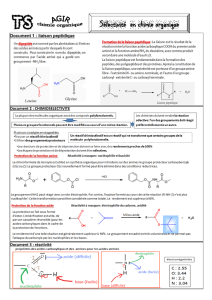
2. Exemple : Réduction chimiosélective.
Dans la molécule suivante (3-nitroacétophénone), deux groupements sont susceptibles d’être
réduit.
Si on veut ne réduire que le groupement –NO2, il faut choisir un réducteur chimiosélectif.
Par exemple le chlorure d’étain dihydraté SnCl2 , 2 H2O.
On obtiendra sélectivement le 3-aminoacétophénone
Groupement carbonyle
Groupement nitro

Documents de Physique-Chimie – M. MORIN
2
II. Protection d’une fonction dans le cas de la synthèse peptidique.
La synthèse peptidique consiste à faire réagir la fonction acide carboxylique d’un acide aminé avec la
fonction amine d’un autre acide aminé.
1. Quel problème apparait lors de la synthèse d’un dipeptide ?
Un problème apparait car sur un même acide aminé coexistent une fonction acide carboxylique et une
fonction amine.
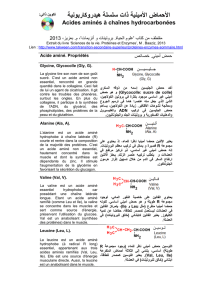
Observons les difficultés qui apparaissent dans la synthèse d’un simple dipeptide tel que alanine-leucine.
Alanine (Ala) Leucine (Leu)
On remarquera qu’à pH 7, ces acides aminés sont sous leurs formes ioniques.
S’il on fait réagir ces deux acides aminés ensemble, il peut apparaître des dipeptides et tripeptides
différents.
Question : Lesquels ?
Méthode : La synthèse peptidique repose sur la réaction entre la fonction –COO- et –NH3+
Réponse :
On peut avoir comme dipeptide Ala-Gly, Ala-Ala et Gly-Gly.
Pour les tripeptides, on peut avoir Ala-Ala-Ala, Ala-Ala-Gly, Ala-Gly-Gly, Gly-Gly-Gly.
2. La solution à ce problème : la protection des groupes fonctionnels.
Activité à partir d’un document
A partir document suivant extrait de « SOLOMON-ORGANIC CHEMISTRY », vous devrez extraire
des informations sur la protection d’une fonction dans le cas de la synthèse peptidique.

Documents de Physique-Chimie – M. MORIN
3
Questions :
1. Entourer en bleu les représentations de l’alanine.
2. Entourer en vert les représentations de la leucine.
3. Entourer en rouge le groupement protecteur de la fonction amine. Quel est son nom anglais ?
4. Entourer en noir le groupement activateur de la fonction acide carboxylique.
5. Donner la formule générale d’un anhydride d’acide.
6. Rédiger un résumé décrivant les 4 étapes principales de cette synthèse peptidique.
chlorométhanoate de benzyle

Documents de Physique-Chimie – M. MORIN
4
Réponses :
Résumé :
La première étape consiste à protéger la fonction amine de l’alanine avec le chlorométhanoate de benzyle.
La seconde étape consiste à activer le groupement cabonyle de l’alanine avec le chlorométhanoate d’éthyle.
La troisième étape consiste à faire réagir la leucine avec l’alanine modifiée.
La quatrième étape consiste à séparer le groupement protecteur de la fonction amine de l’alanine par réduction
catalytique sur paladium.
Chlorométhanoate d’éthyle
Chlorométhanoate de benzyle

Documents de Physique-Chimie – M. MORIN
5
3. Une autre stratégie de synthèse sans activateur.
Dans l’exemple précédent, l’utilisation d’un activateur du groupement –CO2- du premier acide aminé
(Ala), entraine la fixation privilégiée entre de ce groupement avec le –NH3+ du deuxième acide aminé
(Leu).
Le groupement –CO2- du deuxième acide aminé (Leu) ne réagira pas car il est trop peu réactif par
rapport au –CO2- activé du premier acide aminé (Ala).
3.1. Si on n’utilise pas cet activateur, quelle autre liaison pourrait s’établir entre ces acides aminés ?
3.2. Quelle méthode proposez-vous afin de remédier à ce problème ?
3.3. Ecrire les étapes de formation du dipeptide Ala-Leu dans ces conditions.
Réponses :
3.1. Il pourrait s’établir une liaison entre le groupement –CO2- de la leucine (leu) et le groupement –
NH3+ d’un autre acide aminé (Leu). Il se formera du Leu-Leu.
3.2. En plus de la protection habituelle du groupement –NH3+ du premier acide aminé (Ala), on doit
protéger le groupement –CO2- de la leucine (leu).
3.4. Etapes.
- Protection du groupement –NH3+ du premier acide aminé (Ala),
- Protection du groupement –CO2- du deuxième acide aminé (Leu),
- Réaction entre l’alanine et la leucine.
- Déprotection des deux groupements.
Remarque : si on veut poursuivre la synthèse peptidique, il suffit de garder la protection du
groupement –NH3+ du premier acide aminé (Ala) et protéger le groupement –CO2- de l’acide
aminé suivant.
1
/
5
100%