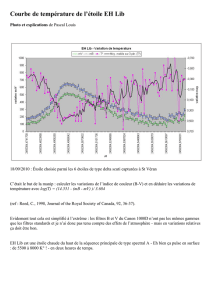
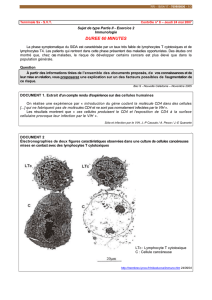
SL-MG

MG 1 : Facteurs influençant la composition d’un système en équilibre
chimique (équilibres ioniques exclus)
Intro : Définitions système, équilibre chimique, variance (BA) Il faut v>2 pour équilibre,
sinon si on change un facteur, rupture d’équilibre. Cet équilibre peut être influencé par de
nombreux facteurs qu’il est important de maîtriser pour avoir le meilleur rendement
possible (industrie).On envisage la modification d’un seul paramètre, tous les autres étant
maintenus constants, cette modification entraînant soit la variation de la constante
d’équilibre thermodynamique (cas de T et du solvant), soit la variation du quotient
réactionnel. Lors de la présentation, il faudra s’efforcer de bien mettre en évidence le fait
que le système est à l’équilibre chimique, et qu’un seul paramètre a été modifié.
I) Equilibres en phase gaz
1) Influence de la pression
2) Influence de la température
Etude de l’équilibre entre NO2 et N2O4 – 45 min – BUP 879 dec 2005 p 1173
Méthode : qualitatif, gaz dans seringue
Manip : influence de P, influence de T
Parler des lois de Van’t hoff et Lechatelier. Faire calcul de variance
MOI
Transition : La température intervient aussi en phase condensée !
II) Equilibres en phase condensée
1) Influence de la température
Enthalpie de dissolution de l’acide benzoïque – 2h – Fosset 106
OU CHALCONE RECRI
Méthode : dosage colorimétrique et pH-métrique
Manip : chute de burette
Attention, solubilité KCl dépend de température, bien vérifier que c’est saturé
Transition : et pour une réaction athermique … ?
2) Influence de l’ajout ou du retrait d’un constituant du système
Equilibre d’estérification – 2h30 – Blanchard p187
Méthode : synthèse, dosage colorimétrique et pH-métrique
Manip : chute de burette
Faire la manip normale pour témoin, la faire avec trois fois plus d’éthanol. Remplacer
acide. Doser avec soude 2 M et pas 0,5 M !
OU JFLM Barbe p 86 DEAN STARK
Transition : dans cet équilibre il n’y avait pas de solvant … et quand il y en a un ?
3) Influence du solvant
Equilibre céto-énolique – 2h – Blanchard p 278 et JD 12
Méthode : Dosage colorimétrique et potentiométrique
Manip : lancement, chute de butette
Modop du JD et solvants du blanchard
Ccl : Importance en industrie de maitriser les équilibres.

MG 2 : Exemples de déterminations de grandeurs standard de réaction
(∆rG°, ∆rH°, ∆rS°)
Intro : Définitions grandeurs standards de réaction (BA)
∆rG°= -T∆rS°+ ∆rH°
D’où on peut les déduire les uns des autres avec une étude de la température.
Reliés à la constante d’équilibre : ∆rG° = -RTlnK°
Important à connaître car détermine équilibre d’une réaction, et donc en partie son
rendement ! (industrie) On va voir qu’il existe une large gamme d’expériences pour les
déterminer.
I) Détermination de ∆rH°
Dosage calorimétrique de H3PO4 – 3h – Souil TP p73, Cachau AB p 190, Fosset p 83
Méthode : Calorimétrie
Manip : Préparation solution, Chute de burette
S’arranger dans les quantités pour avoir un Veq de 15 mL (Il faut un volume d’environ
150 mL dans le Dewar, doser avec soude environ 5M une concentration d’environ 0,20M
d’acide (soit 120 mL d’eau et 30 mL d’acide 1M)
Transition : On a étudié l’enthalpie de neutralisation de l’acide, on peut également
déterminer sa constante d’acidité et remonter ainsi à son enthalpie libre.
II) Détermination de ∆rG°
pKa du BBP – 2h30 – JFLM p 142
Méthode : UV
Manip : préparation solution, Spectre UV
Diviser quantité d’indicateur par 2 sinon saturation de l’absorbance !
On mesure pKa donc ∆rG° à la température de la pièce.
Transition : DrG est relié à DrH et DrS par la température …
III) Détermination de ∆rH° et ∆rS°
1) Mesure de la fem d’une pile à différentes températures
Influence de T sur la fem d’une pile – 2h30 – Brenon Audat p 131
Méthode : pile
Manip : prise de fem à une T donné, augmentation de la température du thermostat
MOI
On dit qu’on reviendra à la fin prendre la fem à la nouvelle température, puis quand on y
revient, on discute de la détermination des grandeurs thermo
Transition : En attendant que T augmente, on s’intéresse à la solubilité de l’acide
benzoïque …
2) Détermination de la solubilité de l’acide benzoïque en fonction de T
Enthalpie de dissolution de l’acide benzoïque – 2h – Fosset p 106
Méthode : dosage colorimétrique et pH-métrique
Manip : chute de burette
Faire que colorimétrique devant le jury
Attention, solubilité KCl dépend de température, bien vérifier que c’est saturé.
Etalonner le pHmètre pour chaque T
Ccl : Importance des grandeurs de réaction mais il ne faut pas oublier cinétique…

MG 3 : Diagrammes binaires (solide-liquide ; liquide-vapeur)
Intro : Souvent on a affaire à des mélanges qui ont des comportements différents. On peut
montrer les deux corps purs solides menthol-phénol on les mets ensemble : fusion. Et les
propriétés du mélange notamment les conditions de changement d’états vont dépendre de la
composition du mélange. Dans le cadre du montage deux composés dans deux phases.
Deux cas différents miscibilité totale dans la phase la plus condensée ou non miscibilité
totale. La variance est alors v= .... On va voir un exemple de tracé de diagramme et des
applications.
I) Mélanges binaires solide-liquide
1) Tracé
Diagramme naphtalène-naphtol – 3h30 – BUP 573 1975 p 810
Méthode : Température changement d’état
Manip : On commence à prendre des températures sur un tube
Diviser quantités par 100, ne pas faire tous les tubes
Transition : Super, on fait quoi avec ça ?
2) Application : abaissement cryoscopique
Chalcone – 1h – JD 90
Méthode : synthèse
Manip : point de fusion
Je lance, celui du limonène continue
On parlera aussi de la manip d’intro, puis de l’application au salage des routes en hiver
Transition : et qu’est-ce qu’on fait avec des binaires liquide-vapeur … ?
II) Mélanges binaires liquide-vapeur
1) Distillation fractionnée
Méthanol isopropanol – 2h – JCE 1992 p A127
Méthode : distillation franctionnée
Manip : indice de réfraction, montage
Transition : Mais si on a un hétéroazéotrope ?
2) Extraction du limonène
Extraction du limonène – 2h30 – Chimie des odeurs et des couleurs p 207
Méthode : Hydrodistillation
Manip : polarimétrie, montage
Diviser par 2. Valeurs correctes pour polaro dans le handbook. Ne pas prendre de
vigreux car hétéroazéotrope
Ccl : Grand intérêt de l’étude de ces diagrammes binaires. Pour de nombreuses applications
de séparations de produits et purification de produits. Dans la vie courante le salage des
routes, antigel dans les radiateurs de voitures (eau/glycol), soudure (étain),…

MG 4 : Interactions soluté-solvant et soluté-soluté
Intro : Définition d’une solution. Pris séparément, les molécules de solvant et celles de
soluté peuvent interagir entre elles via des interactions qui dépendent plus ou moins de
leurs structures (charge, polarité, proticité…). Lorsqu’on met un soluté dans le solvant, on
remplace des interactions solvant-solvant et soluté-soluté par solvant-soluté. Le caractère
énergétiquement favorable de ce remplacement, traduit au niveau microscopique par les
effets de solvatation, détermine la solubilité du soluté dans le solvant. En découlent
également des propriétés fondamentales pour le chimiste, telle que la réactivité du soluté.
Attachons-nous à décrire ces interactions intermoléculaires.
ICO : pour constantes des solvants
I) Interactions solvant soluté
1) Interactions ion-dipôle et solvatation des ions
Solvatation relative des cations alcalins – 2h30 – Fosset p 354
Méthode : Conductimétrie
Manip : Chute burette, préparation solution
Discussion : Interaction électrostatique entre les ions et les molécules d’eau. Eau diminue
les interactions électrostatiques entre les ions due à la forte constante diélectrique.
Application : Permet aussi de renforcer la basicité d’une base -> capture de son contre-ion.
O-alkylation, permet de libérer la nucléophilie des alcoolates. Ou au contraire C-alkylation
avec solvant très peu dissociant.
2) Interactions de Van der Waals
Solubilité et coefficient de partage du diiode dans le DCM et l’eau – 2h30 – Fosset p 115
A METTRE DANS LE MG 18
Méthode : colorimétrie
Manip : Dosage, extraction
Discussion : Diiode apolaire, très polarisable, préfère solvant organique…
Application : Purification par extraction liquide/liquide en chimie organique.
Si il fait vraiment trop chaud, remplacer DCM par toluène moins volatile… mais pas de
valeurs pour comparer.
Transition : ya aussi interactions soluté-soluté …
II) Interactions soluté-soluté
1) Liaisons H
Dimérisation par liaison hydrogène – 3h – Fosset p 383
Méthode : colorimétrie acidobasique
Manip : préparation solution, dosage
Discussion : Importance des liaisons hydrogènes.
Application : Solubilisation de produit.
2) Interactions ion-ion
Mise en évidence de la formation de paires d’ions – 2h – Fosset p 374
Méthode ; UV-vis
Manip : préparation solution, extraction, UV-vis
MOI
Discussion : Interaction électrostatique entre les ions, influence du solvant sur cette
attraction.
Application : Transfert de phase. On amène un ion d’intérêt dans une phase organique.
Ccl : Ces phénomènes sont importants à considérer non seulement pour la solubilité (puis
la miscibilité) de composés, leur extraction (traitement de réactions de synthèse), mais
aussi quand on étudie les différentes chromatographies où les composés interagissent à la
fois avec une phase mobile et stationnaire. Le monde du vivant (structures des
biomolécules, reconnaissance moléculaire…) est structuré autour de ces mêmes
interactions.

MG 5 : Couples acide-base ; constante d’acidité ; influence du milieu
Intro : Deux définitions pour la notion d’acide et de base : on s’interesse à celle de
Bronsted. Notion d’équilibre acide base → equilibre associé à une constante d’acidité Ka
définie pas la loi de Guldberg et Waage (loi d’action de masse). Utilité du Ka. Phénomène
d’acido basicité important, par ex : dans l’organisme humain ou des systèmes complexes
contrôlent l’acidité du sang : une faible variation même faible de cette acidité peut
provoquer la mort. Le pH du sang est naturellement tamponé.
I) Notion de couple acide/base
1) Determination d’une constante d’acidité
pKa du BBP – 2h30 – JFLM p 142
Méthode : UV
Manip : préparation solution, Spectre UV
Diviser quantité d’indicateur par 2 sinon saturation de l’absorbance !
Transition : Connaitre pKa d’un indicateur coloré va être utile pour effectuer des dosages
colorimétriques ! On va voir aussi influence sur comportement d’un couple de la valeur de
son pKa
2) Dosage d’un mélange d’acide
Dosage d’un mélange d’acide – 1h30 – Souil Capes p 145 (et daumarie 181)
Méthode : Colorimétrie et conductimétrie
Manip : Chute de burette
Daumarie pour indicateur coloré
MOI
Transition : Voyons maintenant l’influence di milieu sur acidité des couples …
II) Influence du milieu
1) Influence de la compexation
Dosage acide borique en présence de mannitol – 3h – Fosset p 73
Méthode : pH-métrie
Manip : Préparation solution, chute de burette directement à l’équivalence pour
plusieurs solutions, report de point
Attention erreurs de signe dans l’exploitation du modop
Transition : et solvant ?
2) Influence du milieu
Dosage HCl, HBr en milieu acide acétique – 2h – Brenon Audat p 145
Méthode : potentiométrie
Manip : chute de burette
Ccl : Dans l’industrie : une grande quantité d’acide sulfurique produite chaque année
permet par exemple de fabriquer des engrais ou des polymères. (ça aurait été mieux de
parler de ça en intro pour bien capter l’attention.)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
1
/
37
100%