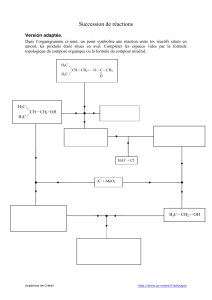
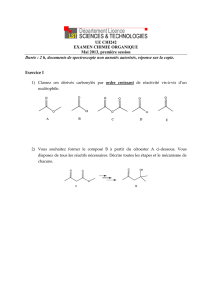
Licence MPC L3‐S5

Licence&MPC&&L3‐S5&
Chimie&Organique&Avancée&
!"#$%&&%'"()%*+,-"*+.#/&(0/1#'2( ( ((((-*1'345(2%(67/8/% ( ((((9+/:%"&/45(2%(;4"*&<#'"=(
Réac:vité&des&dérivés&organiques&du&silicium&

!"#$%&&%'"()%*+,-"*+.#/&(0/1#'2( ( ((((-*1'345(2%(67/8/% ( ((((9+/:%"&/45(2%(;4"*&<#'"=(
I) Introduction sur la chimie du silicium
Structure électronique de Si, tétravalence. Electronégativités comparées entre Si et C; Si dans
l’électronique. Longueurs et énergies de liaisons comparées entre Si-Z et C-Z (Z= C, O, H, F, Cl). Les
dérivés oxydés de Si : silicates, procédé sol-gel. Le silicium dans l’organisme. Les silicones.
II) Réactivité des organosiliciés
1°) Généralités : attaques nucléophiles sur Si; stabilisation des carbanions en α de Si; aptitude des
dérivés de Si à la β-élimination. L’effet β du silicium: stabilisation des carbocations en β de Si.
Applications de l’effet β en synthèse organique: attaques électrophiles sur vinyl, aryl ou allylsilanes.
2°) Substitution d'hydrogène mobile par un groupe silylé
a) Application comme groupe protecteur
Protection des alcools: R-OSiMe3. Les principaux agents de silylation: TMCS, HMDS, TMST
(triflate de TMS), etc… Propriétés générales des dérivés silylés: disparition des liaisons H d'où
abaissement des points de fusion, augmentation de la volatilité (utile en chromatographie en phase
gazeuse), et augmentation de la solubilité en solvants organiques.
Déprotection par MeOH/MeO-, MeOH/H+ (acide citrique) ou KF/DMSO. Usage de t.BuMe2SiCl
comme agent silylant (TBDMS) à déprotection plus difficile (par Bu4N+F-/THF), mais tolérant de
nombreux réactifs de synthèse organique.
>5*1?:/45(2%&(25"/:5&(#"=*+/@'%&(2'(&/3/1/'8(

!"#$%&&%'"()%*+,-"*+.#/&(0/1#'2( ( ((((-*1'345(2%(67/8/% ( ((((9+/:%"&/45(2%(;4"*&<#'"=(
>5*1?:/45(2%&(25"/:5&(#"=*+/@'%&(2'(&/3/1/'8(
3°) Hydrosilylation
Mise en œuvre des propriétés réductrices d'un hydrogénosilane.
a) Réduction des alcènes: différentes conditions de réactions: Δ, peroxyde, rayons γ, ou catalyseur de
Speier: H2PtCl6. Mécanisme radicalaire d'où addition anti-Markovnikov du dérivé silylé.
b) Réduction du carbonyle en alcool [avec le catalyseur de Wilkinson RhCl(PPh3)3].
4°) La réaction de Peterson
Synthèse d'alcènes par β-élimination de Me3SiX. Réactions des dérivés carbonylés
(aldéhydes et cétones) avec les carbanions α-triméthylsilyles. Mécanisme de la β-élimination sur les
β-hydroxyalkyltriméthylsilanes: élimination anti en milieu acide (H+ ou BF3:Et2O), et élimination syn
en milieu basique (KH). Conséquences stéréochimiques sur l'alcène obtenu.
b) Dérivés énoliques: les énoxysilanes
Obtention des énoxysilanes: H mobile en α d'un carbonyle; orientation possible de l'énolisation
suivant les conditions de réaction: cas de la 2-méthylcyclohexanone: énoxysilane le plus substitué par
Me3SiCl/Et3N/DMF, Δ; énoxysilane le moins substitué par 1) LDA-DME; 2) Me3SiCl (-78°C).
Différentes réactions possibles à partir d'un énoxysilane.

!"#$%&&%'"()%*+,-"*+.#/&(0/1#'2( ( ((((-*1'345(2%(67/8/% ( ((((9+/:%"&/45(2%(;4"*&<#'"=(
>5*1?:/45(2%&(25"/:5&(#"=*+/@'%&(2'(&/3/1/'8(
((((A%(&/3/1/'8(%4(+%B%8%+4(8#/+&(53%14"#+5=*?$(@'%(3%(1*"<#+%C(
(6%3*(%+4"*/+%('+%(D#3*"/&*?#+(+#4*<3%(2%(3*(3/*/&#+((
δ
δ
Si C
EFG(!#&&/</3/45(2H*B*@'%(+'135#D7/3%(&'"(3%(&/3/1/'8(
δδ
Si X
Nu
SiNu +X
IFG(;4*</3/&*?#+(2%&(1*"<*+/#+&(%+(α(2'(&/3/1/'8(
Si C
!*"("54"#2#+*?#+(
&'"(3%&(#"</4*3%&(2((
:*1*+4%&(
JFG(KD?4'2%(2'(&/3/1/'8(L(2#++%"(2%&("5*1?#+&(2%(β,53/8/+*?#+((
ML(3N*/2%(2H5358%+4&(1#+2'/&*+4(L(2%&(3/*/&#+&(2%($#"4%(5+%"=/%O(PQ(-Q(63GC(
+L
C C
Me3Si
L
Nu
C C +
Me3SiNu
A%*:/+=(R"#'D(S(="#'D%(D*"4*+4(

!"#$%&&%'"()%*+,-"*+.#/&(0/1#'2( ( ((((-*1'345(2%(67/8/% ( ((((9+/:%"&/45(2%(;4"*&<#'"=(
>5*1?:/45(2%&(25"/:5&(#"=*+/@'%&(2'(&/3/1/'8(
AH%T%4(β(2'(&/3/1/'8(O(
'+(1*"<#1*?#+(%+(β(2'(&/3/1/'8(%&4(4"U&(&4*</3/&5(
C C
Me3Si
α% β%
>%1#':"%8%+4(3*45"*3(%+4"%(3H#"</4*3%(
σ(2%(;/,6Q(%4(3H#"</4*3%(D(:*1*+4%(2'(6(
exemple:
- Me3SiX
Il y a 2 cas typiques:
1°) addition électrophile sur un allylsilane
L’addition de E
conduit à un
carbocation stabilisé en β
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%