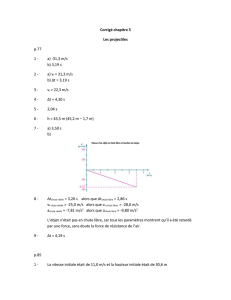
• L`Artémia est le nom scientifique d`un petit crustacé qui possède la

DM préparation BAC BLANC_ Enoncé à rendre avec la copie lundi 25/09 à 13H
Ex 1 : Dosage colorimétrique
• L’Artémia est le nom scientifique d’un petit crustacé qui possède la particularité de pouvoir vivre
dans des milieux très salés tels que certains lacs et marais salants. Pour se développer les Artémia
ont besoin de vivre dans un milieu marin dont la teneur (ou la concentration massique) moyenne en
ions chlorure Cℓ
-(aq)
est supérieure à 30 g.L
-1
. Dans ces conditions, leur développement n’est pas
compromis car les prédateurs aquatiques ne supportent pas des conditions salines aussi élevées.
• Avant d’implanter un élevage d’Artémia dans des marais salants du Sud de la France, on se
propose de déterminer la concentration en ions chlorure d’un prélèvement d’eau d’un marais de la
zone choisie. Cette eau contient exclusivement des ions sodium et des ions chlorure.
• La méthode utilisée permet de doser les ions chlorure par précipitation avec les ions argent Ag
+(aq).
La réaction de précipitation Ag
+(aq)
+ Cℓ
-(aq)
→ AgCℓ
(s)
peut être considérée comme totale. Le
chlorure d’argent formé est un solide blanc.
• L’indicateur coloré de fin de réaction est préparé en dissolvant quelques grains de
dichlorofluorescéine dans un mélange eau-éthanol (méthode de Fajans). La solution obtenue a une
couleur jaune. La présence d’ions sodium Na
+(aq)
, chlorure Cℓ
-(aq)
ou nitrate (NO
3-(aq)
) ne modifie pas
la couleur de la dichlorofluorescéine. Par contre, en présence d’ions Ag
+(aq)
, la solution de
dichlorofluorescéine prend une couleur rose-rouge.
1.
Illustration du fonctionnement de l’indicateur coloré
• On prépare deux tubes à essais, numérotés 1 et 2. Dans chaque tube, on mélange 2,0 mL de
solution de chlorure de sodium (Na
+(aq)
+ Cℓ
-(aq)
) de concentration 0,10 mol.L
-1
et quelques
gouttes de solution de l’indicateur coloré préparé avec la dichlorofluorescéine.
Dans le tube n°1, on ajoute 0,5 mL de solution de nitrate d’argent (Ag
+(aq)
+ NO
3-(aq)
)
de concentration 0,10 mol.L
-1
.
Dans le tube n°2, on ajoute 2,2 mL de solution de nitrate d’argent de concentration 0,10
mol.L
-1
.
1.1.
Quel est le réactif en excès dans chacun des tubes ? Justifier.
1.2.
Quel est l’aspect et la coloration du contenu de chaque tube ?
2.
Principe du dosage
• On veut doser un volume V
1
d’une solution S
1
d’ions chlorure par une solution S
2
de nitrate
d’argent de concentration C
2
.
2.1.
Faire un schéma annoté du dispositif de titrage.
2.2.
Expliquer brièvement comment déterminer l’équivalence.
Rappel : l’équivalence a lieu quand les réactifs sont dans les conditions stœchiométriques.
3.
Préparation de la solution à doser
• En septembre 2003, après un été caniculaire, on a prélevé un échantillon d’eau dans un marais
salant, de la zone prévue pour implanter l’élevage d’Artémia. On dilue 10 fois cette eau pour
obtenir la solution S
1
à doser.
3.1.
On souhaite obtenir 50 mL de la solution S
1
. Quel volume d’eau doit-on prélever ?
3.2.
Désigner et nommer la verrerie à utiliser pour effectuer cette dilution. Expliquer brièvement le
mode opératoire.
4.
Exploitation du dosage
Donnée : masse molaire atomique du chlore : M(Cℓ) = 35,5 g.mol
-1
• On réalise le dosage d’un volume V
1
= 10,0 mL de solution S
1
par une solution S
2
de nitrate
d’argent de concentration C
2
= 1,00 × 10
-1
mol.L
-1
. Le volume de nitrate d’argent versé à
l’équivalence est : V
E
= 15,2 mL.
4.1.
Déterminer la concentration molaire des ions chlorure dans la solution S
1
.
4.2.
En déduire la concentration molaire des ions chlorure dans l’eau du marais.
4.3.
Cette eau est-elle favorable au développement des Artémia ?

Ex 2 : Sports aux USA
Les parties A, B et C sont indépendantes.
A - Première phase : Durant cette phase, on néglige toutes les actions liées à l'air ainsi que le poids de
la balle.
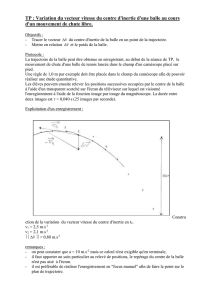
1. La première phase est illustrée par les figures 1 et 2 représentées sur la photographie ci-dessus et
schématisée par la figure 4. Au point A, la balle est immobile. Entre les points A et B, elle reste en
contact avec la crosse. La force
F
r
exercée par la crosse sur la balle, supposée constante, est
représentée sur la figure 4. Le segment AB représentant la trajectoire de la balle est incliné d'un angle α
= 30° avec l'horizontale.
Données : - masse de la balle : m = 160 g - intensité du champ de pesanteur : g = 9,81 m.s
-2
.
1.1. Énoncer la deuxième loi de Newton et l'appliquer à la balle lors de son trajet entre A et B.
1.2. Que peut-on dire de la nature du mouvement de la balle entre A et B ?
2. La force
F
r
s'exerce pendant une durée ∆t = 0,11 s. La balle part du point A sans vitesse initiale et
arrive en B avec une vitesse
telle que v
B
=14 m.s
-1
.
2.1. Donner l'expression du vecteur accélération en fonction du vecteur vitesse.
2.2. Calculer la valeur de l'accélération du centre d'inertie de la balle entre les points A et B.
3. En utilisant les résultats obtenus en 1.1.2, calculer l'intensité de la force exercée sur la balle par la
crosse. L'hypothèse concernant le poids de la balle est-elle justifiée ? B - Deuxième phase
Au point B, la balle quitte la
crosse à la date t = 0 avec le
vecteur vitesse
contenu
dans le plan (xOz) ; c'est la
deuxième phase du
mouvement correspondant à
la figure 3 de la photographie.
On néglige toutes les actions
liées à l'air.
On étudie le mouvement du centre d'inertie G de la balle dans le champ de pesanteur supposé
uniforme. Le système d'axes utilisé est représenté sur le schéma ci-dessous : l'axe Ox est horizontal
dirigé vers la droite et Oz est vertical et dirigé vers le haut. L'origine des axes est située à la verticale du
point B telle que OB = h = 0,40 m.
1. Trajectoire de la balle.
1.1. Donner l'expression des coordonnées v
Bx
et v
Bz
du vecteur vitesse
de la balle à l'instant
t= 0 s, en fonction de v
B
et de α.
1.2. Donner l'expression des coordonnées x
B
et z
B
du vecteur
uuur
OB
de la balle au point B.
1.3. En appliquant la deuxième loi de Newton, on obtient les équations horaires suivantes:
x
Gz
a 0
a
a g
=
= −
uur
= α
= α −
r
x B
z B
v v .cos
v
v v .sin gt
Montrer que la valeur vs de la vitesse de la balle au sommet S de la trajectoire est v
s
= 12 m.s
-1
.
1.4. Montrer que les coordonnées du vecteur position
uuur
OG
du centre d'inertie de la balle sont
les suivantes :
uuur
OG
1.5. En déduire l'équation de la trajectoire de la balle.
2. La ligne de but est située à une distance d = 15 m du point O. La hauteur du but est L = 2,14 m. On
néglige le diamètre de la balle devant la hauteur du but.
x
z
O
h
But
B
α
(
)
( )
B
2
B
x = v .cos
αt
1
z = h + v .sin
αt - g.t
2

2.1. Quelles conditions doivent satisfaire x et z pour que le but soit marqué ?
2.2. Vérifier que ces conditions sont bien réalisées.
C - Étude énergétique
Le même tir est réalisé du milieu du terrain à une distance du but supérieure à 15 m.
On rappelle les valeurs suivantes ; OB = h = 0,40 m ; v
B
= 14 m.s-1 ; vitesse au sommet S de la
trajectoire : vS=12 m.s-1. L'énergie potentielle de pesanteur Ep(0) est choisie nulle à l'altitude z= 0.
1. Donner l'expression littérale de l'énergie potentielle de pesanteur E
P
puis celle de l'énergie
mécanique E
M
de la balle en fonction de g, m, v et z.
2. Calculer l'énergie mécanique E
M
(B) de la balle au point B.
3. Toutes les actions de l'air sont négligées.
3.1. Que peut-on dire de la valeur de l'énergie mécanique E
M
de la balle au cours de son
mouvement ?
3.2. Exprimer l'altitude maximale z
max
que pourrait atteindre la balle au point S dans ces
conditions, en fonction de E
M
, v
s
, m et g. Calculer la valeur de z
max
.
Ex 3 : Un acide de l'organisme : l'acide lactique
1)
L’acide produit par l’organisme lors d’une acidose métabolique est l’acide
lactique. C'est un acide faible de formule brute C
3
H
6
O
3
.
Recopier la représentation de l’acide lactique figurant ci-contre puis entourer et nommer les groupes
caractéristiques.
2)
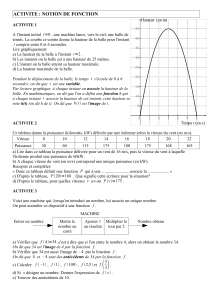
La figure représente deux simulations de courbes de titrage pH-métrique de deux solutions
aqueuses acides différentes par une solution aqueuse d’hydroxyde de sodium (Na
+(aq)
+ HO
-(aq)
).
Les deux acides sont l'acide chlorhydrique, un acide fort et l'acide lactique, un acide faible.
La concentration molaire en soluté apporté des deux solutions aqueuses d’acide est c = 1,0 × 10
-2
mol.L
-1
.
2 .1. Calculer le pH de la solution d'acide fort avant l’ajout de la solution aqueuse de soude et en
déduire la courbe correspondant à son titrage pH-métrique.
pH
V (mL)
courbe 1
courbe 2

2.2. On donne l'équation de la réaction de titrage de l’acide lactique :
CH
3
CHOHCOOH
(aq)
+ HO
- (aq)
→ CH
3
CHOHCOO
–(aq)
+ H
2
O
(l)
En utilisant la méthode des tangentes pour la courbe 1, déterminer le volume à l’équivalence V
E
2.3. Montrer que pour un volume de solution aqueuse de soude ajouté égal à V
E
2, V
E
étant le volume
versé à l’équivalence, le pH de la solution vaut pK
A
.
2.4. En déduire à partir de la figure une estimation du pK
A
de l’acide lactique.
3.
La précision d'un titrage
Un élève effectue le titrage colorimétrique d'un volume V
A
= (20,0 ± 0,05) mL d'une solution aqueuse
d'acide lactique de concentration molaire attendue c
A
= (2,22 ± 0,005) × 10
-2
mol.L
-1
par une solution de
aqueuse de soude étiquetée « concentration c
B
= (3,00 ± 0,01) × 10
-2
mol.L
-1
».
3.1.
La valeur du volume à l’équivalence relevée par un élève est V
E
= (10,1 ± 0,3) mL.
L’estimation de l’incertitude sur la mesure est liée au repérage de l’équivalence et à la
précision de la burette dans les conditions de l’expérience. Déterminer la concentration
molaire expérimentale c
Aexp
en acide lactique, obtenue par l’élève.
On définit l’incertitude relative d’une grandeur X par le rapport ∆X
X. On estime qu’une incertitude relative
est négligeable devant une autre, si elle est environ dix fois plus petite.
3.2.
Montrer que les incertitudes relatives sur V
A
et c
B
sont négligeables devant celle sur V
E
.
3.3.
Dans cette hypothèse, on peut montrer que l’incertitude relative ∆c
Aexp
c
A
est égale à ∆V
E
V
E
. En
déduire l’encadrement de la concentration molaire en acide lactique c
Aexp
, obtenue par
l’élève.
3.4.
L’encadrement de la concentration molaire obtenue expérimentalement est-elle cohérente
avec l’encadrement de la concentration molaire attendue ? Justifier.
3.5.
Quelle(s) raison(s) pourrai(en)t expliquer un écart éventuel entre l’encadrement attendu et
l’encadrement expérimental ?
Ex 4 : Ondes
L'inspecteur Clouseau doit déterminer la vitesse d’un fuyard. Le fuyard est parti avec une ambulance,
sirène hurlante. Par chance, un témoin a enregistré la fuite avec son téléphone portable.
L’ambulance munie d'une sirène se déplace vers la droite à la vitesse v inférieure à c. La sirène retentit
et émet un son de fréquence f = 680 Hz.
1. Le véhicule se rapproche d'un observateur immobile.
Pendant l'intervalle de temps T, le son parcourt la distance λ. Pendant ce temps, le véhicule parcourt la
distance d = v. T.
La longueur d'onde λ' perçue par l'observateur à droite de la source S a donc l'expression suivante :
λ' = λ – v.T (1)
1.1. Rappeler la relation générale liant la vitesse de propagation, la longueur d'onde et la fréquence.
1.2. En déduire que la relation (1) permet d'écrire
(f ’ étant la fréquence sonore perçue par l'observateur).
1.3. Le son perçu est-il plus grave ou plus aigu que le son d'origine ? Justifier.
2. Dans un deuxième temps, le véhicule s'éloigne de l'observateur à la même
vitesse v.
2.1. Donner, sans démonstration, les expressions de la nouvelle longueur
d'onde λ" et de la nouvelle fréquence f " perçues par l'observateur en fonction de
f, v et c.
2.2. Le son perçu est-il plus grave ou plus aigu que le son d'origine ? Justifier.
3. Exprimer, puis estimer en km.h
-1
, en arrondissant les valeurs à des nombres entiers, la vitesse du
véhicule qui se rapproche de l'observateur sachant que ce dernier perçoit alors un son de fréquence
f ' = 716 Hz.
1
/
4
100%