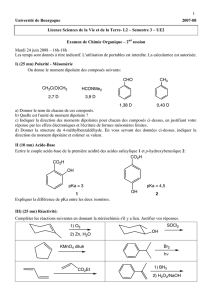
Chapitre 7 : Activité 2 : Les solvants moléculaires Le rôle des solvant

Chapitre 7 : Activité 2 : Les solvants moléculaires
Le rôle des solvant est multiple en chimie. Il peut servir en tout premier lieu à dissoudre les réactifs
intervenant dans une réaction chimique et à permettre la rencontre des molécules réagissantes, mais il
peut aussi être utilisé dans un objectif de purification et d'isolement d'un produit.
Document 1 : Processus de dissolution d'une espèce chimique
La dissolution dans l'eau de composés possédant des liaisons partiellement ioniques (fortement
polarisées) s'effectue en trois étapes successives :
–Etape d'ionisation : création de paire d'ions
–Etape de dissociation (ou dispersion) : séparation de la paire d'ions
–Etape de solvatation : établissement d'interactions entre les ions et le solvant (hydratation dans le
cas de l'eau.)
Lorsque l'espèce chimique qu'on mélange au solvant est neutre, lorsqu'elle ne possède pas de liaisons
polarisées, la mise en solution se déroule en une seule étape de solvatation.
Document 2 : Caractéristiques des solvants
Moment dipolaire (noté
μ
, unité Debye, D) : déjà évoqué précédemment, le moment dipolaire traduit
l'irrégularité de la répartition des charges dans une molécule.
Permittivité diélectrique relative (notée
ϵr
) : grandeur physique intervenant dans l'énergie
d'interaction de Coulomb dans un milieu matériel, elle permet de quantifier le pouvoir dispersant d'un
solvant. Grandeur sans unité, toujours supérieure à 1.
Proticité : Un solvant protique est un solvant constitué par des molécules potentiellement donneuses de
protons H+ (possédant un atome d'hydrogène H polarisé positivement). Un solvant aprotique ne possède
pas cette propriété.
Le terme de solvant polaire est utilisé en chimie (organique en particulier), sans être très clairement
défini. Ce terme cherche à spécifier qu'un solvant est apte à solubiliser des solutés ioniques ou possédant
des groupements possédant une forte dissymétrie de charge.
Document 3 : Données sur quelques solvants : classés par ordre croissant de polarité
Solvant
μ
(D)
ϵr
Formule
Cyclohexane 0 2
Benzène 0 1,15
Ether diéthylique 1,15 4,2
Acétate d'éthyle 1,78 6

Cyclohexanone 2,9 18,3
Acétone 2,88 20,7
Ethanol 1,69 24,8
Méthanol 1,7 32,7
Eau 1,85 18,5
Questions
Processus de dissolution :
1- Schématiser les trois étapes de mise en solution dans l'eau du chlorure d'hydrogène HCl. Pour chaque
étape, préciser les interactions et les énergies mises en jeu.
2- Schématiser la dissolution du glucose, espèce neutre, peu polarisable, dans l'eau. Préciser les énergies
mises en jeu lors du processus.
3- En s'appuyant sur l'expression de l'énergie d'interaction de Coulomb dans un milieu matériel, expliquer
pourquoi un solvant possédant un permittivité diélectrique relative importante est dit très dissociant.
4- De quelle caractéristique physique du solvant l'étape d'ionisation dépend-elle ? Expliquer son rôle.
5- Que se passe-t-il si on introduit le chlorure d'hydrogène HCl dans un solvant peu ionisant ? dans un
solvant ionisant mais peu dissociant ?
6- Existe-t-il un lien entre permittivité diélectrique et moment dipolaire d'un solvant ?
7- L'affirmation suivante est-elle vraie : « plus le moment dipolaire d'un solvant est grand, plus le solvant
est dit polaire. »
Solubilité et miscibilité :
8- A quelle(s) condition(s) sur les énergies mises en jeu dans le processus de dissolution, une espèce
chimique sera-t-elle soluble dans un solvant donné ?
Un bilan des interactions montre que la condition précédemment citée est respectée si le solvant et le
soluté ont des propriétés similaires. Ainsi une molécule pourra se dissoudre dans un solvant possédant
des caractéristiques similaires en terme de polarité et/ou de proticité, et deux solvants miscibles
possèdent là encore des propriétés similaires.
→ Qui se ressemble, s'assemble.
9- L'eau est-elle miscible avec : l'éthanol ? le cyclohexane ? le benzène ? l'acétone?
10- Expliquer pourquoi le glucose est très soluble dans l'eau (jusqu'à 900g/L) ?
11- Dans quel solvant le diiode est-il le plus soluble : eau ou cyclohexane ?
12- On indique ci-dessous les valeurs de la solubilité s de plusieurs gaz dans l'eau à
20°C, exprimée en mol.L-1, sous la pression atmosphérique.
gaz H2CH4C2H6
s 8,0.10-4 1,5.10-3 2,0.10-3
→ Comment peut-on interpréter l'évolution constatée ?
13- La solubilité du dioxyde de carbone de carbone dans l'eau est de 3,8.10-2mol.L-1, tandis que celle du
dioxyde de soufre SO2 est de 1,77. Comment expliquer cette importante différence ?
Glucose

14- Cette même solubilité est égale à 31,1 mol.L-1 pour l'ammoniac NH3. Comment expliquer cette
différence aussi importante ?

CORRECTION
Processus de dissolution :
1- Schématiser les trois étapes de mise en solution dans l'eau du chlorure d'hydrogène HCl. Pour chaque
étape, préciser les énergies mises en jeu.
Ionisation : HCl → H+Cl- (formation de la paire d'ions)
La polarisation de la liaison est accrue jusqu'à donnée deux ions, liés entre eux par une interactions de
type électrostatique (énergie d'interaction de coulomb).
Dissociation (dispersion) : H+CL- → H+ …..... Cl-
Les deux ions sont séparés, il faut apporter de l'énergie au système (sous forme thermique) pour séparer
les deux ions (déstabilisation du système).
Solvatation : H+ → H+(aq) Cl- → Cl-(aq)
L'étapes de solvatation est une étape de création d'interactions attractives (d'origine électrostatique) entre
le solvant et les ions. Ces interactions sont stabilisantes.
2- Schématiser la dissolution du glucose, espèce neutre, peu polarisable, dans l'eau. Préciser les énergies
mises en jeu lors du processus.
Il y a simplement une étape de solvatation. D'abord les différentes molécules de glucose sont en « bloc »,
à l'état solide. Elles sont liés entre elles par des liaisons de types Van der Walls et hydrogène. Ces
interactions sont brisées, chaque molécule de glucose est solvatées par des molécules d'eau et dispersés, il
se créé des interactions de types VdW et liaisons hydrogènes entre le glucose et les molécules d'eau.
3- En s'appuyant sur l'expression de l'énergie d'interaction de Coulomb dans un milieu matériel, expliquer
pourquoi un solvant possédant un permittivité diélectrique important est dit très dissociant.
L'énergie de l'interaction de Coulomb entre une charge +q et une charge -q séparées par une distance r
s'exprime par :
dans le vide :
Ecoulomb=−q2
4π ϵ0r
dans un milieu matériel :
Ecoulomb=−q2
4π ϵ0ϵrr
Comme
ϵr
est toujours supérieur à 1, les interactions coulombiennes dans la matière sont toujours plus
faibles que dans le vide. Plus le
ϵr
d'un solvant est important, plus l'interaction sera faible, donc il sera
plus plus facile de dissocier les deux ions. C'est pourquoi on dit que le solvant est dissociant si
ϵr
est
supérieur à 15.
4- De quelle caractéristique physique du solvant l'étape d'ionisation dépend-elle ? Expliquer son rôle.
Un solvant sera ionisant si son moment dipolaire est important.
En effet, le moment dipolaire créé un champ électrique. Lorsqu'on introduit des solutés partiellement
ioniques, le champ électrique accentue l'irrégularité des charges de la liaison polarisés jusqu'à former des
ions.
5- Que se passe-t-il si on introduit le chlorure d'hydrogène HCl dans un solvant peu ionisant ? dans un
solvant ionisant mais peu dissociant ?
Dans un solvant non ionisant, par exemple le cyclohexane, il ne sera formera pas de paires d'ions (donc
pas de dissociation). HCl sera directement solvaté, la liaison entre H et Cl est conservée.
Dans un solvant ionisant il y aura formation de paires d'ions, mais elles ne seront pas dissociées. Par
exemple, le chlorure de potassium K+Cl- est à 99% sous forme de paires d'ions dans l'acide acétique (
ϵr
= 6,2), alors qu'il n'y a aucune paires d'ions dans l'eau.

6- Existe-t-il un lien entre permittivité diélectrique et moment dipolaire d'un solvant ?
Il n'y a pas de lien direct. On constate cependant que en général les solvant apolaires sont peu dissociant
alors que les solvants polaires sont dissociants.
7- L'affirmation suivante est-elle vraie : « plus le moment dipolaire d'un solvant est grand, plus le solvant
est dit polaire. »
Non ce n'est pas vrai, on voit que l'eau est le solvant dit le plus polaire alors que ce n'est pas la molécule
qui a le plus grand moment dipolaire. Pour discuter de la polarité d'un solvant il faut tenir compte des
deux effets ionisation/dissociation et de l'ensemble de la molécule. Par exemple le cyclohexanone possède
certes un grand moment dipolaire, mais localisé sur la fonction carbonyle, le reste de la molécule étant
apolaire le solvant n'est en définitif pas très polaire.
Solubilité et miscibilité :
8- A quelle(s) condition(s) sur les énergies mises en jeu dans le processus de dissolution, une espèce
chimique sera-t-elle soluble dans un solvant donné ?
L'espèce chimique va se dissoudre si l'énergie de solvatation est supérieure aux énergies d'interactions qui
lient les molécules dans le solide original.
Un bilan des interactions montre que la condition précédemment citée est respectée si le solvant et le
soluté ont des propriétés similaires. Ainsi une molécule pourra se dissoudre dans un solvant possédant
des caractéristiques similaires en terme de polarité et/ou de proticité, et deux solvants miscibles
possèdent là encore des propriétés similaires.
→ Qui se ressemble, s'assemble.
9- L'eau est-elle miscible avec : l'éthanol ? le cyclohexane ? le benzène ? l'acétone?
Eau : solvant polaire protique
Ethanol : polaire + protique → miscibilité infinité
Cyclohexane et benzène : apolaire aprotique → non miscible
Acétone : polaire aprotique → miscible (mais pas à l'infini)
10- Expliquer pourquoi le glucose est très soluble dans l'eau (jusqu'à 900g/L) ?
C'est un composé qui peut former de nombreuses liaisons hydrogènes donc il est très
soluble dans l'eau.
11- Dans quel solvant le diiode est-il le plus soluble : eau ou cyclohexane ?
Diiode : légèrement soluble dans l'eau car il est très polarisable (grand nuage électronique), mais c'est une
molécule apolaire, elle sera donc plus soluble dans cyclohexane. (voir TP coefficient de partage diiode).
12- On indique ci-dessous les valeurs de la solubilité s de plusieurs gaz dans l'eau à 20°C, exprimée en
mol.L-1, sous la pression atmosphérique.
gaz H2CH4C2H6
s 8,0.10-4 1,5.10-3 2,0.10-3
→ Comment peut-on interpréter l'évolution constatée ?
On remarque que la solubilité est très faible car ce sont des molécules apolaires, alors que l'eau est un
solvant polaire. Une partie peut tout de même se solubiliser grâce aux interactions de type London
(polarisabilité). Plus les molécules sont grosses, plus elles sont polarisables c'est pourquoi la solubilité
augmente.
13- La solubilité du dioxyde de carbone de carbone dans l'eau est de 3,8.10-2mol.L-1, tandis que celle du
dioxyde de soufre SO2 est de 1,77. Comment expliquer cette importante différence ?
Dioxyde de carbone → molécule linéaire → pas de moment dipolaire donc peu soluble.
Le dioxyde de soufre est une molécule coudée (doublet non liant sur le S) → molécule polaire → plus
soluble dan l'eau
14- Cette même solubilité est égale à 31,1 mol.L-1 pour l'ammoniac NH3. Comment expliquer cette
Glucose
 6
6
1
/
6
100%