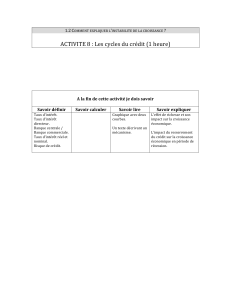
CHAPITRE 2 Modélisation du transfert gaz

CHAPITRE 2
Modélisation du transfert gaz-liquide couplé aux réactions
chimiques dans l’écoulement de liquide autour d’une bulle
2.1 Présentation du système étudié
2.1.1 Système liquide-gaz
Ce chapitre est consacré à la modélisation mathématique du transfert gaz-liquide de CO2
qui prend place au sein des colonnes BIR. Nous considérons le transfert de CO2depuis une
bulle de gaz, contenant un mélange de N2et de CO2, vers une solution aqueuse contenant un
mélange de NaHCO3et Na2CO3.
Ces deux phases sont séparées par une interface. Cette dernière est supposée n’offrir aucune
résistance au transfert de matière, ce qui a été montré expérimentalement dans le cas du
transfert de CO2[25]. La résistance au transfert de l’interface est négligeable devant les
résistances en phase liquide et éventuellement en phase gazeuse.
Dans le cas de l’absorption de CO2dans des solutions de carbonate et bicarbonate de
sodium, une hypothèse souvent rencontrée dans la littérature est de considérer que la résistance
de la phase gazeuse au transfert de CO2est négligeable devant celle en phase liquide [1, 26, 27].
Dès lors, dans tout ce qui suit, nous considérons que la vitesse du transfert gaz-liquide de
CO2ne dépend que des phénomènes prenant place dans la phase liquide.
Le CO2étant soluble dans l’eau, il traverse l’interface et est absorbé par la phase liquide.
Ce transfert peut être représenté par l’équation suivante :
CO2(g)CO2(l)(2.1)
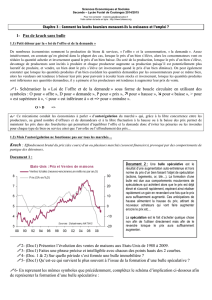
Le CO2provenant de la bulle de gaz est transporté dans la phase liquide par convection et
diffusion moléculaire. La diffusion est un processus de transfert apparaissant sous l’effet d’un
gradient de concentration, tandis que la convection est un processus de transport sous l’effet
du mouvement d’ensemble du fluide [4], comme représenté à la figure 2.1.
Dans le cas d’une solution aqueuse de carbonate et bicarbonate de sodium, les autres es-
pèces présentes en solution sont OH−,HCO−
3,CO2−
3et Na+. Dans les conditions industrielles,
le pH de ces solutions se situe aux alentours de 10.
Pour les espèces ioniques, un processus supplémentaire, appelé migration, peut s’ajouter
à la diffusion. Il apparaît sous l’effet du champ électrostatique induit par la diffusion des

Figure 2.1: Représentation des processus de transport en phase liquide du CO2provenant d’une bulle
de gaz.

2 . Modélisation du transfert gaz-liquide couplé aux réactions chimiques dans
l’écoulement de liquide autour d’une bulle 14
espèces chargées [28]. Suivant l’orientation de ce champ et la charge des ions, il peut s’ajouter
ou s’opposer à la diffusion. Toutefois, des simulations réalisées au début de ce travail [29] ont
montré que la contribution de cet effet est négligeable sur la vitesse globale du transfert de CO2.
C’est pourquoi, afin de ne pas alourdir inutilement la présentation des systèmes d’équations et
leur résolution numérique, elle n’est pas prise en compte dans la modélisation.
2.1.2 Réactions chimiques en phase liquide
Dans les colonnes BIR, le CO2transféré depuis les bulles de gaz et transporté dans la
phase liquide participe à des réactions chimiques. En solution aqueuse basique, les réactions
suivantes prennent place [1, 10, 11, 27, 30, 31] :
CO2+ OH−HCO−
3(2.2)
HCO−
3+ OH−CO2−
3+ H2O(2.3)
Désignons par r1et r2respectivement les vitesses des réactions (2.2) et (2.3). Ces vi-
tesses sont positives si les réactions se déroulent de gauche à droite et négatives dans le cas
contraire. Dans la littérature, ces vitesses de réactions sont supposées être du premier ordre en
les concentrations [10, 11] . Elles s’écrivent donc :
r1=k11 [CO2][OH−]−k12[HCO−
3](2.4)
r2=k21 [HCO−
3][OH−]−k22[CO2−
3](2.5)
où k11,k12,k21 et k22 sont les constantes cinétiques. Nous supposons que ces réactions ne
se déroulent qu’à proximité de l’interface bulle-liquide, dans une mince couche de liquide en
contact avec l’interface.
Loin de l’interface bulle-liquide, dans le cœur de la phase liquide, que nous appelons le
bulk, l’équilibre thermodynamique est supposé être atteint. En effet, le temps de séjour du
liquide dans les colonnes BIR est très grand devant les temps caractéristiques des réactions
(quelques heures par rapport à quelques secondes). Les concentrations dans le bulk sont donc
les concentrations d’équilibre.
Appelons K1et K2respectivement les constantes d’équilibre des réactions (2.2) et (2.3).
A l’équilibre chimique, les concentrations vérifient le système suivant :
K1=[HCO−
3]
[CO2][OH−](2.6)
K2=[CO2−
3]
[HCO−
3][OH−](2.7)
De plus, à l’équilibre, les concentrations totales en carbone et en sodium, que nous notons
CC,T et CNa+,T , doivent également vérifier les relations suivantes :
CC,T = [CO2] + [HCO−
3] + [CO2−
3](2.8)
CNa+,T = [HCO−
3] + 2[CO2−
3](2.9)
Pour déterminer complètement l’état du système, deux de ces inconnues doivent être fixées.


2 . Modélisation du transfert gaz-liquide couplé aux réactions chimiques dans
l’écoulement de liquide autour d’une bulle 15
Deux voies sont utilisées :
- soit nous fixons [HCO−
3]et [CO2−
3];
- soit nous fixons les concentrations initiales, avant mise à l’équilibre, en NaHCO3et en
Na2CO3, respectivement à [NaHCO3]ini et [Na2CO3]ini.
Nous déterminons alors CC,T et CNa+,T par :
CC,T = [NaHCO3]ini + [Na2CO3]ini (2.10)
CNa+,T = [NaHCO3]ini + 2 [Na2CO3]ini (2.11)
Ces équations nous servent par la suite pour déterminer les conditions de concentration
loin de l’interface bulle-liquide.
2.1.3 Caractéristiques des écoulements autour de bulles
La grande majorité des colonnes à bulles industrielles fonctionne soit en régime d’écoule-
ment homogène, soit en régime hétérogène [22, 24, 32].
Le régime d’écoulement homogène est obtenu lorsque la fraction volumique de gaz Ô(le
rapport du volume de gaz sur le volume total du mélange liquide-gaz) est inférieure à une
certaine valeur critique Ôcrit. Ce Ôcrit se situe aux alentours de 15 %. En régime homogène,
toutes les bulles ont à peu près la même taille et leur diamètre est compris entre 2 et 6 mm.
Le régime d’écoulement hétérogène, quant à lui, est obtenu lorsque Ôest supérieur à ce
Ôcrit. Il existe alors deux familles de bulles [22, 32] :
– des petites bulles, dont le diamètre est compris entre 2 et 6 mm ;
– des grandes bulles, qui ont une taille comprise entre 5 et 8 cm.
La phase gazeuse dans une colonne est donc répartie entre ces deux populations de bulles.
Ces deux populations ne sont toutefois pas indépendantes puisqu’elles interagissent via des
processus de coalescence et de rupture.
La densité d’aire interfaciale d’une bulle est le rapport entre la surface de cette bulle et
son volume. Les petites bulles ont une densité d’aire interfaciale beaucoup plus importante
que celle des grandes bulles. Dès lors, le transfert de CO2, de la phase gazeuse vers la phase
liquide dans une colonne BIR, est principalement dû aux petites bulles (plus de 90 %). C’est
pourquoi nous nous concentrons sur les caractéristiques de l’écoulement du liquide autour de
ces petites bulles.
Toutefois, les grandes bulles participent indirectement au transfert. Elles jouent en quelque
sorte le rôle de "réservoir" de CO2[22]. En effet, le CO2contenu dans les petites bulles
est rapidement transféré dans la phase liquide. La vitesse du transfert de CO2décélérerait
rapidement avec la hauteur si les petites bulles évoluaient seules dans la colonne.
Les phénomènes de coalescence-rupture des bulles ont tendance à égaliser les concentra-
tions en CO2entre les deux familles de bulles [22]. Ces phénomènes conduisent globalement à
un transfert de CO2depuis la population des grandes bulles vers la population des petites bulles,
ce qui maintient la quantité de CO2dans la famille des petites bulles à des valeurs importantes.
La vitesse relative des bulles par rapport au liquide est appelée vitesse de glissement, que
nous notons G. Pour les petites bulles, dont le diamètre est compris entre 2 et 6 mm, cette
vitesse est plus ou moins indépendante du diamètre et est comprise entre 0,15 et 0,25 m/s,
selon la composition de la phase aqueuse. Ces petites bulles sont de forme ellipsoïdale [22, 33].
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
1
/
86
100%