Etude de l`effet de différents effecteurs (diosgénine, léflunomide) sur

UNIVERSITE DE LIMOGES
ECOLE DOCTORALE Science-Technologie-Santé
FACULTE de PHARMACIE
Année : 2005 Thèse N°
Thèse
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE DE LIMOGES
Discipline / Spécialité : Biologie Cellulaire et Biochimie
Présentée et soutenue par
Pascale VERGNE-SALLE
le 20 décembre 2005
Etude de l’effet de différents effecteurs (diosgénine, léflunomide)
sur la synthèse de cytokines et l’expression de COX-2
dans les synoviocytes humains de type B de polyarthrite rhumatoïde.
Identification des voies de transduction du signal.
Thèse dirigée par M. le Professeur Jean-Louis BENEYTOUT
JURY :
M. le Professeur F. BERENBAUM Rapporteur
M. le Professeur P. GILLET Rapporteur
M. le Professeur J.L. BENEYTOUT Examinateur
M. le Professeur R. TREVES Examinateur
M. le Professeur P. BERTIN Examinateur
M. le Docteur B. LIAGRE Examinateur

1
UNIVERSITE DE LIMOGES
FACULTÉ DE PHARMACIE
DOYEN DE LA FACULTE : Monsieur le Professeur HABRIOUX Gérard
ASSESSEURS : Madame le Professeur CHULIA Dominique
Monsieur COMBY Francis, Maître de Conférences
PROFESSEURS :
BENEYTOUT Jean-Louis BIOCHIMIE - BIOLOGIE MOLECULAIRE
BOTINEAU Michel BOTANIQUE - CRYPTOGAMIE
BROSSARD Claude PHARMACIE GALENIQUE
BUXERAUD Jacques CHIMIE ORGANIQUE - CHIMIE THERAPEUTIQUE
CARDOT Philippe CHIMIE ANALYTIQUE
CHULIA Albert PHARMACOGNOSIE
CHULIA Dominique PHARMACIE GALENIQUE
DELAGE Christiane CHIMIE GENERALE – CHIMIE MINERALE
DREYFUSS Gilles PARASITOLOGIE
DUROUX Jean-Luc PHYSIQUE - BIOPHYSIQUE
GHESTEM Axel BOTANIQUE - CRYPTOGAMIE
HABRIOUX Gérard BIOCHIMIE FONDAMENTALE
LACHATRE Gérard TOXICOLOGIE
MOESCH Christian HYGIENE – HYDROLOGIE - ENVIRONNEMENT
OUDART Nicole PHARMACODYNAMIE
ROGEZ Sylvie BACTERIOLOGIE – VIROLOGIE
MAITRES DE CONFERENCES
ALLAIS Daovy PHARMACOGNOSIE
BASLY Jean Philippe CHIMIE ANALYTIQUE
BATTU Serge CHIMIE ANALYTIQUE – BROMATOLOGIE
CALLISTE Claude BIOPHYSIQUE
CARDI Patrice PHYSIOLOGIE
CLEDAT Dominique CHIMIE ANALYTIQUE
COMBY Francis CHIMIE THERAPEUTIQUE
DELEBASSEE Sylvie BACTERIOLOGIE - VIROLOGIE
DREYFUSS Marie Françoise CHIMIE ANALYTIQUE – BROMATOLOGIE
FAGNERE Catherine CHIMIE ORGANIQUE
FROISSARD Didier BOTANIQUE – CRYPTOGAMIE

2
JAMBUT Anne Catherine CHIMIE THERAPEUTIQUE
LAGORCE Jean François CHIMIE ORGANIQUE
LARTIGUE Martine PHARMACODYNAMIE
LIAGRE Bertrand SCIENCES BIOLOGIQUES
LOTFI Hayat TOXICOLOGIE
MARION-THORE Sandrine CHIMIE THERAPEUTIQUE
MARRE-FOURNIER Françoise BIOCHIMIE
MOREAU Jeanne IMMUNOLOGIE
PARTOUCHE Christian PHYSIOLOGIE
POUGET Christelle PHARMACIE GALENIQUE
ROUSSEAU Annick BIOMATHEMATIQUE
SIMON Alain CHIMIE PHYSIQUE – CHIMIE MINERALE
TROUILLAS Patrick BIOMATHEMATIQUES – INFORMATIQUE
VIANA Marylène PHARMACIE GALENIQUE
VIGNOLES Philippe INFORMATIQUE
PROFESSEUR CERTIFIE
MARBOUTY Jean-Michel ANGLAIS
ATER
COURTIOUX Bertrand Sce M. le Prof. DREYFUSS
DUMETRE Aurélien Sce M. le Prof. DREYFUSS et MOESCH
FAURE Sébastien Sce Mme le Prof. OUDART
YAHIAOUI Samir Sce M. le Prof. BUXERAUD

3
Résumé
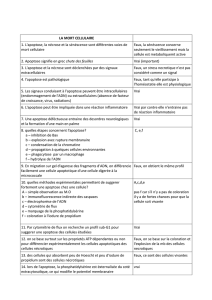
Bien que les mécanismes exacts conduisant à l’inflammation et à la destruction ostéo-articulaire
dans la polyarthrite rhumatoïde (PR) ne soient pas connus, cette maladie auto-immune se
caractérise par l’activation de multiples cellules immunitaires aboutissant à la synthèse de
cytokines pro-inflammatoires et de différents effecteurs de la destruction ostéo-articulaire
comme les métalloprotéases et la prostaglandine E
2
(PGE
2
). D’autre part, l’hyperplasie synoviale
agressive est probablement liée à un défaut d’apoptose des cellules synoviales. Notre travail a été
réalisé dans un modèle de culture de synoviocytes fibroblastiques humains de PR. La première
partie du travail est consacrée à l’étude de l’apoptose et de l’expression de la cyclooxygénase-2
(COX-2) dans les cellules synoviales traitées par la diosgénine, un stéroïde végétal. La deuxième
partie concerne les mécanismes d’action du léflunomide, utilisé dans le traitement de la PR et
notamment ses effets sur les cytokines pro- et anti-inflammatoires.
Nos résultats montrent pour la première fois que la diosgénine entraîne une inhibition de la
croissance, une apoptose des cellules synoviales, associées à une induction de l’expression de
COX-2. Le processus apoptotique déclenché par la diosgénine entraînee une chute du potentiel
membranaire mitochondrial, l’activation de la caspase-3 et une fragmentation de l’ADN. Les
effets pro-apoptotiques de la diosgénine sont associés à une surexpression de COX-2 corrélée à
une augmentation de la production de PGE
2
endogène.
L’A77 1726, métabolite actif du léflunomide, est responsable à forte dose (100 µM) d’une
augmentation de la sécrétion d’interleukine (IL)-10, d’une diminution de la production d’IL-11
et n’a pas d’effet sur celles du récepteur soluble du tumor necrosis factor-α (sTNFRI) et de l’IL-
8. Nos résultats confirment que l’A77 1726 est responsable d’une diminution de la production
d’IL-6 et de PGE
2
et d’une augmentation de l’antagoniste du récepteur de l’IL-1 (IL-1Ra). Les
effets de l’A77 1726 semblent associés à une activation de la mitogen-activated protein kinase
(MAPK) p38. Enfin, l’A77 1726 est un puissant inhibiteur de l’activation du nuclear factor-κB
(NF-κB) induite par l’IL-1β.
MOTS CLES
:
Polyarthrite rhumatoïde, synoviocytes humains, diosgénine, léflunomide, cytokines,
interleukine-10, interleukine-11, apoptose, MAPK, NF-κB, cyclooxygénase-2

4
Abstract
Although the exact physiopathology of rheumatoid arthritis (RA) is unknown, this chronic
inflammatory joint disease is characterized by the activation of multiple immune cells,
production of pro-inflammatory cytokines and synthesis of different destructive factors such as
metalloproteases and prostaglandin E
2
(PGE
2
). In addition, alterations in the apoptosis of
synovial cells is probably responsible for synovial hyperplasia. We studied the effects of
diosgenin, a plant steroid, and the effects of leflunomide, a disease-modifying antirheumatic drug
in a model of cultured human RA fibroblast synovial cells (RA FLS).
First, diosgenin inhibits RA FLS growth with apoptosis induction associated with
cyclooxygenase-2 (COX-2) upregulation. We observed a loss of mitochondrial membrane
potential, caspase-3 activation and DNA fragmentation after diosgenin treatment. These results
suggest that the proapoptotic effect of diosgenin is associated with COX-2 overexpression
correlated with overproduction of endogenous PGE
2
. In the second part of the study, we showed
that hight dose of A77 1726 (100 µM), the active metabolite of leflunomide, increased
interleukin(IL)-10 secretion, decreased IL-11 release and had no effect on tumor necrosis factor-
α soluble receptor I (sTNFRI) and IL-8 secretion in IL-1β-stimulated RA FLS. Furthermore, our
results confirmed that A77 1726 decreases IL-6 and PGE
2
synthesis while it increases IL-1
receptor antagonist (IL-1Ra) secretion. The effect of A77 1726 on IL-10 and IL-11 secretion
seemed to be associated with the status of p38 mitogen-activated protein kinase (MAPK)
activation. Furthermore, A77 1726 was a potent inhibitor of nuclear factor-κB (NF-κB)
activation induced by IL-1β in human RA FLS.
KEY WORDS:
Rheumatoid arthritis, human synoviocytes, diosgenin, leflunomide, cytokines, interleukin-10,
interleukin-11, apoptosis, MAPK, NF-κB, cyclooxygenase-2.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
1
/
184
100%