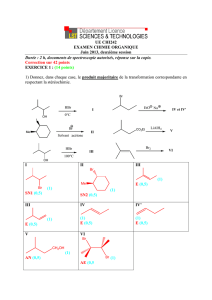
1999 - associations

KAMPEL Rafael
Travaux Pratiques
Chimie Organique IB
Semestre d’hiver 1998/99
Assistant : J. Jodry
Projet n° 26 :
Genève, le 28 janvier 1999

1. Introduction
Cette expérience a pour but de synthétiser l’acide cinnamique (aussi connu sous le nom
d’acide phényl-acrylique ou encore acide-3-phenyl-2-propenoïque) à partir de benzaldéhyde
et d’acide malonique.
La réaction se déroule comme décrit ci-dessous :
L’acide cinnamique est un produit intéressant car il porte plusieurs groupes fonctionnels,
un groupe carboxylique, une fonction alcène et une fonction phényle. Ce composé est souvent
utilisé dans l’industrie alimentaire en tant que parfum dû à son goût de cannelle.
2. Résultats et discussion
Cette synthèse se fait en quelques étapes dont voici un aperçu :
1. La déprotonnation du groupement aldéhyde par la pipéridine.
2. La formation d’un ion iminium, plus sensible aux attaques nucléophiles.
3. L’attaque nucléophile par l’acide malonique.
4. La perte d’une molécule de gaz carbonique et formation d’acide cinnamique.
Cette suite de réactions se fait selon le mécanisme décrit ci-dessous :
On remarque que la pipéridine est le catalyseur de cette réaction ; une fois la molécule
d’acide cinnamique formée, elle déprotonera encore une autre molécule de benzaldéhyde et
CHO+COOH
COOH
COOH
Benzaldéhyde Acide Malonique Acide Cinnamique
CO
H+NH N+
Ion iminium
N
COOH
HOOC
COOH
COOH
+
N
HOOC O
O
-CO2
COOH
-OH-
N

ainsi de suite, jusqu’à ce que tout ait réagi. De ce fait, le rendement sera pratiquement
quantitatif.
La pipéridine est donc essentielle au déroulement de cette synthèse car c’est elle qui
transforme le substrat en ion iminium, favorisant l’attaque nucléophile. Ce qu’il résulte de
l’association de l’acide malonique avec cet ion est une réaction appelée condensation de
Knoevenagel où l’on assiste à une perte d’une molécule d’eau et de gaz carbonique.
Lors de l’analyse du spectre nous détectons tous les protons correspondants à notre
produit mais également des traces d’eau. Sur le spectre IR on peut constater que toutes nos
valeurs correspondent avec les données de référence. Ces spectres seront décrits de façon plus
détaillée lors de la partie expérimentale.
Le rendement pour cette réaction est de l’ordre de 70%.
3. Questions
1. Votre produit sera-t-il cis ou trans ? (Tfus cis : 68°C ; Tfus trans : 133°C)
Le point de fusion mesuré se situe entre 130-133°C. Le produit est donc exclusivement
trans et l’on peut conclure que la réaction est stéréoséléctive.
2. Proposez une synthèse différente de l’acide cinnamique.
Il existent plusieurs autres méthodes de synthèse de l’acide cinnamique. Une méthode
simple en théorie, mais difficilement réalisable en pratique pourrait être par déshydratation de
son alcool correspondant, l’acide-3-phenyl-2-ol.
Les méthodes ressemblant à celle utilisée sont en effet les plus simples à réaliser. Une
méthode proposée dans la littérature est de faire réagir le benzaldéhyde avec de l’acétone et
BF3 dans le toluène.
4. Conclusion
Cette synthèse est une méthode extrêmement simple et fiable pour produire de l’acide
cinnamique. De surcroît, la recristallisation est facile et la synthèse offre un très bon
rendement.
5. Partie expérimentale
5.1 Mode opératoire
Réactifs employés :
• Benzaldéhyde : 3,02g (28,5 mmol)
• Acide malonique : 4,22g (40,5 mmol)
• Pyridine : 3,0 ml
• Pipéridine : 5 gouttes
Les réactifs ont été placés dans un ballon rond muni d’un réfrigérant et chauffés au bain-
marie à 120°C (T. éb. Pyridine : 115,2°C) pendant 2h30. Une fois le dégagement de CO2

cessé, la solution est versée dans une solution de 20 ml de HCl dans 100 ml d’eau. On
récupère ce qui reste dans le ballon en le rinçant à l’HCl dilué. Le précipité est alors isolé sur
Büchner, lavé à l’eau et recristallisé dans un mélange eau/EtOH 2 :1. Le produit est
finalement séché et son point de fusion mesuré.
5.2 Résultats
La quantité finale de produit récupéré est de 2,96g, ce qui correspond à 20,0 mmol. On
calcule alors le rendement sachant que le réactif limitant est le benzaldéhyde et que la quantité
de produit attendue est donc de 28,5 mmol. On trouve alors un rendement de 70%.
5.3 Analyse des spectres
On analyse premièrement les spectres IR en comparant les valeurs de référence avec les
valeurs de l’échantillon mesuré :
Référence 2681 2591 1670 1615 1412 1307
Pratique 2692 2599 1693 1634 1415 1309
Référence 1282 1220 980 942 766 709
Pratique 1283 1193 980 777 717
On peut alors attribuer les principaux pics aux fonctions les plus caractéristiques au sein
de la molécule :
• ~3030 cm-1 : C-H stretching du groupement aryle
• ~2700 - 2600 cm-1 : O-H stretching de l’acide carboxylique
• 1690 cm-1 : -COOH conjugué
• ~1630 cm-1 : -C=C- stretching
• 1580 cm-1 : benzène substitué
• 980 cm-1 : C-H « out of plane deformation »
et l’on décèle également comme solvant l’eau, qui absorbe à 3523 cm-1 dû à son
groupement OH.
Le spectre RMN nous offre plus d’informations du point de vue structural de la molécule.
La première particularité est un couplage indirect spin-spin au sein de la molécule, ce qui
produit deux singulets résonant à des fréquences différentes. Ces signaux proviennent des
regions à ~6,5 PPM et ~7,8 PPM.
On peut d’ailleurs confirmer ceci en calculant leurs constantes de couplage : pour le
premier proton nous avons J = 15,92 Hz et pour le deuxième J = 16,00 Hz.
Les protons du noyau aromatiques se situent comme toujours aux alentours de 7,27 PPM
et le dernier proton, appartenant au groupement carboxylique, il n’apparaît pas sur le spectre
car il se trouve aux environs de 13 PPM.
6. Références
• Vollhardt, Schore ; Traité de Chimie Organique, 2ème Ed., 1995, ch. 17.
• Dictionary of Organic Compounds, 5th ed.
1
/
4
100%