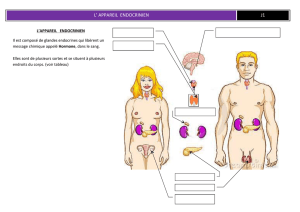
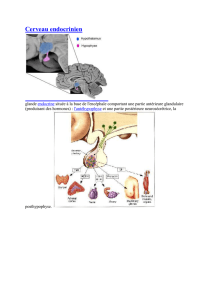
hormones - Faculté de médecine vétérinaire

PATHOLOGIE
DU
SYSTÈME ENDOCRINIEN
DMV 2220
D. Martineau, DMV, MSc, PhD, Dipl. ACVP
Département de Microbiologie et Pathologie
Faculté de Médecine Vétérinaire
Université de Montréal
2003

ii
TABLE DES MATIÈRES- PLAN DE COURS
1. HORMONES..............................................................................................................8
1.1 Classes chimiques d'hormones....................................................................................................................8
1.1.1 Polypeptides (protéines) ....................................................................................................................8
1.1.2 Stéroïdes .............................................................................................................................................8
1.1.3 Catécholamines et iodothyronines ....................................................................................................11
1.1.4 Prostaglandines.................................................................................................................................11
2. MALADIES HORMONALES....................................................................................12
2.1 Pas assez d'hormones.................................................................................................................................12
2.2 Trop d'hormones........................................................................................................................................12
3. HYPOPHYSE...........................................................................................................13
3.1 Développement...........................................................................................................................................13
3.2 Anatomie.....................................................................................................................................................14
3.3 Anomalies de développement ....................................................................................................................14
3.3.1 Anomalies spontanées de développement.........................................................................................14
a) Kystes du canal crânio-pharyngien 14
! Kystes extrasellaires (pharyngiens) .......................................................................................14
! Kystes intrasellaires...............................................................................................................14
b) Déficience en hormone de croissance - Hyposomatotropisme. 15
c) Anencéphalie. 16
d) Causes héréditaires des problèmes de développement hypophysaire (bovins). 16
3.3.2 Anomalies de développement dues à un agent toxique.....................................................................16
3.4 Inflammation de l'hypophyse....................................................................................................................16
3.5 Tumeurs de l'hypophyse............................................................................................................................17
3.5.1 Chien.................................................................................................................................................17
a) Adénomes 17
! Maladie de Cushing...............................................................................................................17
! Syndrome adipo-génital.........................................................................................................18
! Hypersomatotropisme (excès d'hormone de croissance (= GH)............................................18
b) Crâniopharyngiome 19
3.5.2 Cheval...............................................................................................................................................19
4. SURRÉNALES.........................................................................................................21
4.1 Anatomie.....................................................................................................................................................21
4.2 Lésions du cortex surrénalien...................................................................................................................22
4.2.1 Hémorragies du cortex surrénalien...................................................................................................22
a) Causes 22
! Bactéries................................................................................................................................22

iii
! Virus......................................................................................................................................22
! Agents toxiques .....................................................................................................................22
4.2.2 Télangiectasie du cortex surrénalien.................................................................................................23
4.2.3 Hypoadrénocorticisme (Atrophie cortico-surrénale chez le chien, (Maladie d'Addison)) = le
« contraire » du syndrome de Cushing).............................................................................................23
A) INSUFFISANCE CORTICOSURRÉNALE PRIMAIRE (atrophie idiopathique du cortex) 23
! Inflammation: tuberculose, histoplasmose, blastomycose .....................................................24
! Métastases .............................................................................................................................24
! Amyloïde...............................................................................................................................24
1) Déficience en aldostérone. Bien que les hormones produites par les trois couches corticales
soient produites en moins grandes quantités, c’est surtout la déficience en aldostérone qui
produit les signes cliniques les plus graves............................................................................24
Normalement, l'aldostérone augmente l'excrétion urinaire de potassium et la réabsorption de
sodium. Donc, la déficience en aldostérone entraîne :...........................................................24
2) Déficience en glucocorticoïdes:..............................................................................................25
3) Augmentation d'ACTH...........................................................................................................25
B) INSUFFISANCE CORTICOSURRÉNALE SECONDAIRE 25
4.2.4 Hyperadrénocorticisme (entraînant le syndrome de Cushing) (= le « contraire» fonctionnel de la
maladie de Addison).........................................................................................................................25
Étiologie 25
Causes 26
! Adénome hypophysaire (maladie de Cushing) ......................................................................26
! Adénome du cortex surrénal (syndrome de Cushing)............................................................26
! Hyperadrénocorticisme (hypothalamique) idiopathique........................................................27
! Syndrome de Cushing iatrogénique.......................................................................................27
! Sécrétion ectopique d'ACTH.................................................................................................28
b) Lésions / signes cliniques associés à l'hyperadrénocorticisme 28
! 1. Polyurie et polydipsie........................................................................................................28
! 2. Polyphagie.........................................................................................................................29
! 3. Faiblesse musculaire et atrophie........................................................................................29
! 4. Abdomen pendulaire..........................................................................................................29
! 5. Lésions cutanées................................................................................................................30
! 6. Ostéoporose.......................................................................................................................31
! 7. Hypertrophie du clitoris / atrophie testiculaire ..................................................................31
! 8. Infections du tractus urinaire, urolithiase...........................................................................31
! 9. Pancréatite aiguë................................................................................................................31
! 10. Insuffisance cardiaque.....................................................................................................31
! 11. Thromboembolisme pulmonaire......................................................................................31
c) Diagnostic de la cause d’hyperadrécnocorticisme 32
d) Causes fréquentes de mort dans l'hyperadrénocorticisme 33
4.2.5 Lésions prolifératives du cortex surrénalien sans hyperadrénocorticisme ........................................33
4.3 Lésions prolifératives de la médulla : hyperplasie et tumeurs (phéochromocytomes).........................33
5. THYROÏDE...............................................................................................................35
5.1 Anatomie.....................................................................................................................................................35
5.2 Hormones thyroïdiennes (iodothyronines)...............................................................................................35
5.3 Anomalies de développement ....................................................................................................................37
5.3.1 Kystes du canal thyréoglosse............................................................................................................37
5.3.2 Thyroïdes accessoires.......................................................................................................................38

iv
5.4 Hypothyroïdisme........................................................................................................................................38
5.4.1 Fréquence..........................................................................................................................................38
5.4.2 Causes...............................................................................................................................................38
a) Hypothyroïdisme primaire 38
b) Hypothyroidisme secondaire 38
5.4.3 Signes cliniques ................................................................................................................................38
5.4.4 Thyroïdite auto-immune ...................................................................................................................39
a) Lésions 39
b) Causes possibles de la thyroïdite auto-immune 40
5.4.5 Thyroïdite infectieuse. ......................................................................................................................40
5.4.6 Hypoplasie........................................................................................................................................40
a) Porcs 41
b) Moutons 41
5.4.7 Atrophie de la thyroïde d'origine hypophysaire................................................................................41
5.4.8 Hyperplasie (Goitre).........................................................................................................................41
a) Définition 41
b) Fréquence 42
c) Causes: 42
! Déficience en iode.................................................................................................................42
! Substances goitrogéniques.....................................................................................................42
! Dyshormogenèse familiale.....................................................................................................43
! Malnutrition, émaciation........................................................................................................43
! Certains médicaments............................................................................................................43
! Oestrogènes ...........................................................................................................................43
d) Types de goitre 44
e) Signes cliniques d'hypothyroïdisme congénital 45
5.5 Tumeurs de la thyroïde..............................................................................................................................47
5.5.1 Chiens...............................................................................................................................................47
a) Adénomes 47
b) Adénocarcinomes 47
c) Tumeurs mixtes 48
d) Tumeurs des cellules C (cellules parafolliculaires), carcinome médullaire de la thyroïde 48
5.5.2 Chevaux............................................................................................................................................48
5.5.3 Bovins...............................................................................................................................................48
5.5.4 Chats (Hyperthyroïdisme félin). Hyperplasie thyroïdienne et/ou adénomes.....................................48
! Facteurs de risque..................................................................................................................49
! Étiologie ................................................................................................................................49
! Lésions...................................................................................................................................49
6. PARATHYROÏDE.....................................................................................................51
6.1 Anatomie.....................................................................................................................................................51
6.2 Physiologie de l'os ......................................................................................................................................51
6.2.1 Ostéoblastes......................................................................................................................................51
6.2.2 Ostéoclastes ......................................................................................................................................51
6.2.3 CONTRÔLE DE LA RÉSORPTION OSSEUSE.............................................................................52

v
6.2.4 Parathormone (PTH).........................................................................................................................52
a) Parathormone et os 52
b) Parathormone et reins 53
! Mécanisme direct...................................................................................................................53
! Mécanisme indirect................................................................................................................53
6.2.5 Protéine reliée à la parathyroïde .......................................................................................................53
6.2.6 Vitamine D........................................................................................................................................53
6.2.7 Calcitonine........................................................................................................................................55
6.2.8 Homéostasie du calcium...................................................................................................................56
6.3 Hyperparathyroïdisme ..............................................................................................................................56
6.3.1 Types d’hyperparathyroïdisme..........................................................................................................57
- Causes d'hypercalcémie chez les espèces autres que canines 58
- Intoxication à la vitamine D ou à des composés ayant activité de vitamine D..........................58
a) Hyperparathyroïdisme primaire 58
b) Hyperparathyroïdisme secondaire 59
! Hyperparathyroïdisme nutritionnel........................................................................................59
! Hyperparathyroïdisme rénal ..................................................................................................60
Ostéodystrophie fibreuse d'origine rénale........................................................61
c) Hyperparathyroïdisme "tertiaire" 61
6.3.2 Pathophysiologie de l'hypercalcémie................................................................................................61
6.4 Hypoparathyroïdisme................................................................................................................................62
6.4.1 Causes...............................................................................................................................................62
a) Parathyroïdite auto-immune 62
b) Hypoparathyroïdisme primaire idiopathique 62
c) Hypoparathyroidisme iatrogénique 62
d) Hypoparathyroidisme nutritionnel 62
! Vache laitière.........................................................................................................................63
7. PANCRÉAS ENDOCRINIEN ...................................................................................64
7.1 Anatomie du pancréas ...............................................................................................................................64
7.2 Physiologie du pancréas endocrin.............................................................................................................64
7.2.1 Cellules bêta et insuline....................................................................................................................64
7.2.2 Glucose et insuline............................................................................................................................64
7.3 Diabète sucré (mellitus) .............................................................................................................................65
7.3.1 Définition : HYPERGLYCÉMIE à jeun (élévation persistante du glucose sanguin). Fréquent chez le
chien, surtout femelles adultes..........................................................................................................65
7.3.2 Causes de diabète mellitus chez les animaux.................................................................................... 67
a) Destruction du pancréas 67
! Nécrose pancréatique aiguë...................................................................................................67
b) Antagonisme (épuisement des cellules β des îlots) 68
c) Amyloidose des îlots pancréatiques chez les chats 70
d) Hypoplasie des îlots pancréatiques 71
7.3.3 Animaux affectés par le diabète sucré...............................................................................................71
7.3.4 Pathophysiologie du diabète mellitus................................................................................................71
7.3.5 Pathologie clinique ...........................................................................................................................72
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
1
/
78
100%