CHM-1004 : Thermodynamique et cinétique chimique

© Université Laval Page 1 de 8
Faculté des sciences et de génie
Département de chimie
PLAN DE COURS
CHM-1004 : Thermodynamique et cinétique chimique
NRC 11536 | Hiver 2016
PrésentielMode d'enseignement:
4-0-5Temps consacré: 3Crédit(s):
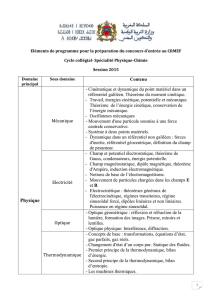
Éléments de thermodynamique statistique. Théorie cinétique des gaz. Équations d'état des gaz: gaz parfaits, gaz de Van der Waals, états
correspondants. Première loi de la thermodynamique. Thermochimie. Deuxième loi. Entropie. Énergie libre. Équilibres de phases d'un
corps pur. Cinétique chimique: lois de vitesse, mécanismes réactionnels. Théorie élémentaire des collisions.
Attention: Veuillez prendre note que la plage horaire du lundi de 15h30 à 17h20 est une session de dépannage facultatif.
Plage horaire
Cours en classe
mardi 10h30 à 12h20 VCH-3820 Du 11 janv. 2016 au 22 avr. 2016
mercredi 10h30 à 12h20 VCH-2840 Du 11 janv. 2016 au 22 avr. 2016
Atelier
lundi 15h30 à 17h20 VCH-2860 Du 11 janv. 2016 au 22 avr. 2016
Il se peut que l'horaire du cours ait été modifié depuis la dernière synchronisation avec Capsule. Vérifier l'horaire dans Capsule
Site de cours
https://www.portaildescours.ulaval.ca/ena/site/accueil?idSite=67191
Coordonnées et disponibilités
Thanh-Tung Nguyen-Dang
Enseignant

© Université Laval Page 2 de 8
Soutien technique
Pour recevoir du soutien technique relatif à l'utilisation du Portail des Cours, contactez :
Comptoir LiberT (FSG)
Pavillon Adrien-Pouliot, Local 3709
418-656-2131poste 4651
Session d'automne et hiver
Lundi 08h00 à 18h45
Mardi 08h00 à 18h45
Mercredi 08h00 à 18h45
Jeudi 08h00 à 18h45
Vendredi 08h00 à 16h45
Session d'été
Lundi 08h00 à 16h00
Mardi 08h00 à 16h00
Mercredi 08h00 à 16h00
Jeudi 08h00 à 16h00
Vendredi 08h00 à 16h45

© Université Laval Page 3 de 8
Description du cours .......................................................................................................................... 4
Objectifs ................................................................................................................................................................................................................................. 4
Objectifs spécifiques ........................................................................................................................................................................................................... 4
Aide pédagogique ................................................................................................................................................................................................................ 4
Contenu et activités ........................................................................................................................... 4
Évaluations et résultats ..................................................................................................................... 5
Consignes sur les examens ................................................................................................................................................................................................ 5
Modalités d'évaluation ....................................................................................................................................................................................................... 5
Informations détaillées sur les évaluations sommatives ............................................................................................................................................ 5
Partiel 1 Thermo. ........................................................................................................................................................................................................... 5
Partiel 2 mec. stat. ........................................................................................................................................................................................................ 6
Partiel 3 Cinétique ........................................................................................................................................................................................................ 6
Devoir 1 ........................................................................................................................................................................................................................... 6
Devoir 2 ........................................................................................................................................................................................................................... 6
Devoir 3 ........................................................................................................................................................................................................................... 6
Devoir 4 ........................................................................................................................................................................................................................... 6
Devoir 5 .......................................................................................................................................................................................................................... 6
Devoir 6 ........................................................................................................................................................................................................................... 7
Détails sur les modalités d'évaluation ............................................................................................................................................................................. 7
Échelle des cotes .................................................................................................................................................................................................................. 7
Politique sur l'utilisation d'appareils électroniques ..................................................................................................................................................... 7
Politique sur le plagiat et la fraude académique .......................................................................................................................................................... 7
Étudiants ayant un handicap, un trouble d’apprentissage ou un trouble mental ................................................................................................ 8
Matériel didactique ............................................................................................................................ 8
Matériel complémentaire ................................................................................................................................................................................................... 8
Médiagraphie et annexes ................................................................................................................... 8
Bibliographie ......................................................................................................................................................................................................................... 8
Sommaire

© Université Laval Page 4 de 8
Objectifs
Dans ce cours, l'étudiant(e) sera initié(e) aux principes généraux de chimie physique à travers deux matières fondamentales, la
thermodynamique et la cinétique chimique. Le cours comporte trois parties: Dans la première partie, faisant appel aux trois lois de la
thermodynamique classique,l'étudiant(e) apprendra à établir le bilan énergétique et entropique d'une transformation chimique et à en
prédire la direction spontanée. Dans la deuxième partie, il(elle) apprendra à utiliser la distribution de Maxwell-Boltzmann dans l'analyse
des excitations thermiques des molécules et à décrire les propriétés des gaz selon la théorie cinétique. Finalement, l'étudiant(e)
apprendra, dans la troisième partie, à décrire l'évolution temporelle des systèmes réactionnels, à définir la vitesse d'une réaction et à
l'analyser en termes de mécanismes réactionnels plausibles.
Objectifs spécifiques
Au terme du cours, l'étudiant(e) serait en mesure
•d'énoncer et d'appliquer les trois lois de la thermodynamique,
•de calculer et d'interpréter les chaleurs de réaction, de prédire le sens spontané d'une transformation chimique et d'en établir les
conditions d'équilibre,
•de décrire, à l'aide de la loi de Maxwell-Boltzmann, la distribution des molécules d'un ensemble macroscopique sur les niveaux
d'énergie moléculaire,
•d'utiliser cette distribution pour calculer les contributions de différents types de mouvement moléculaire à l'énergie interne et à la
capacité calorifique d'un gaz parfait
•d'énoncer les hypothèses moléculaires des modèles de gaz parfait, de Van der Waals et de la théorie simple des collisions
moléculaires,
•de distinguer entre réactions élémentaires et réactions complexes. de définir et de déterminer l'ordre, la constante de vitesse et
l'énergie d'activation d'une réaction élémentaire.
•de déterminer les constantes de vitesse et la constante d'équilibre d'un système réactionnel réversible par une méthode de
relaxation.
•d'appliquer l'hypothèse d'état stationnaire dans l'analyse des mécanismes de réactionset/ou l'hypothèse de prééquilibre
complexes.
Aide pédagogique
Ateliers (travaux dirigés, TD) hebdomadaires sous la responsabilité d'un étudiant-tuteur. Horaire: tous les lundis,15h30-17h20, VCH-3820.
Le tableau ci-dessous présente les semaines d'activités prévues dans le cadre du cours.
Titre Date
Chapitre I: Première loi de la thermodynamique
A. Terminologie de thermodynamique. B. Première loi: un principe de conservation- Travail et
chaleur-Fonctions d'état vs. fonctions de passage. C. Enthalpie: définition. Enthalpies de réactions:
thermochimie.
Chapitre II: Seconde loi de la thermodynamique.
A. Entropie et désordre. Seconde loi de la thermodynamique. B. Calculs d'entropie. Troisièeme loi de la
thermodynamique. C. Énergies libres. Calculs thermochimiques. D. Application: Équilibre de phase d'un corps
pur (matière complémentaire)
Chapitre III: Éléments de mécanique statistique
A. Niveaux d'énergie moléculaire. B. Distribution de Maxwell-Boltzmann. C. Application: calculs de l'énergie
interne et de la capacité calorifique d'un gaz parfait.
Description du cours
Contenu et activités

© Université Laval Page 5 de 8
Titre Date
Chapitre IV: Théorie cinétique des gaz
A. Distributions de vitesses. B. Équations d'état de gaz parfait, de van der Waals. C. Théorie simple de collisions
moléculaires.
Chapitre V: Concepts de cinétique chimique
A. Vitesse de réaction. Réactions élémentaires et réactions complexes. Ordre et molécularité. B. Collisions
moléculaires et constante de vitesse d'une réaction bimoléculaire. C. Lois de vitesse de réactions simples:
formes différentielles et intégrales. Temps de demi-réaction.
Chapitre VI: Réactions complexes.
A. Réaction inversables. Constantes de vitesse et constante d'équilibre. Cinétique de relaxation. B. Réactions
consécutives. Notion d'étape déterminante et d'état stationnaire. C. Mécanismes de réactions complexes:
principe d'analyse cinétique. Hypothèses d'état stationnaire et de pré équilibre.
Notes de cours (2011)
Notes de cours du professeur
Note : Veuillez vous référer à la section de votre site de cours pour de plus amples détails.Contenu et activités
Consignes sur les examens
Documents permis aux examens: aide mémoire fourni par le professeur et tableaux de constantes et de données thermodynamiques.
Modalités d'évaluation
Titre Date Mode de travail Pondération
Examens (Somme des évaluations de ce regroupement) 75 %
Partiel 1 Thermo. Le 17 févr. 2016 de 10h30 à
12h20
Individuel 30 %
Partiel 2 mec. stat. Le 30 mars 2016 de 10h30 à
12h20
Individuel 20 %
Partiel 3 Cinétique Le 26 avr. 2016 de 10h30 à
12h20
Individuel 25 %
Devoirs (Somme des évaluations de ce regroupement) 25 %
Devoir 1 Dû le 2 févr. 2016 à 18h00 Individuel 5 %
Devoir 2 Dû le 16 févr. 2016 à 18h00 Individuel 3,75 %
Devoir 3 Dû le 15 mars 2016 à 18h00 Individuel 5 %
Devoir 4 Dû le 29 mars 2016 à 18h00 Individuel 2,5 %
Devoir 5 Dû le 13 avr. 2016 à 18h00 Individuel 5 %
Devoir 6 Dû le 26 avr. 2016 à 18h00 Individuel 3,75 %
Informations détaillées sur les évaluations sommatives
Partiel 1 Thermo.
Date : Le 17 févr. 2016 de 10h30 à 12h20
Évaluations et résultats
Sommatives
 6
6
 7
7
 8
8
1
/
8
100%