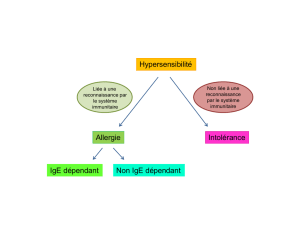
les recepteurs solubles de cytokines

UNIVERSITE DE NANTES
FACULTE DE MEDECINE
Mise en Evidence d'une Forme Soluble de la Chaîne
Alpha du Récepteur de l’Interleukine-15 Humaine :
Caractérisation Structurale et Fonctionnelle
THESE DE DOCTORAT
Ecole Doctorale : Chimie-Biologie
Discipline : Sciences de la Vie et de la Santé
Spécialité : Immunologie
Présentée et soutenue par
Erwan MORTIER
Le 21 Octobre 2005, devant le jury ci-dessous
Président :
François LANG Professeur des Universités, Nantes
Rapporteurs :
Bruno AZZARONE Directeur de Recherche, Villejuif
Hervé WATIER Professeur des Universités-PH, Tours
Examinateurs :
Hugues GASCAN Directeur de Recherche, Angers
Ariane PLET Chargée de Recherche, Nantes
Directeur de thèse :
Yannick JACQUES Directeur de Recherche, Nantes
- 1 -

Table des Matières
TABLE DES MATIÈRES
TABLE DES MATIÈRES__________________________________________________2
LISTE DES ABRÉVIATIONS _____________________________________________6
LISTE DES FIGURES ET TABLEAUX____________________________________10
RESUMÉ _______________________________________________________________11
ABSTRACT_____________________________________________________________12
INTRODUCTION ________________________________________________________13
LES CYTOKINES ET LEURS RECEPTEURS _______________________________14
I. Généralités. ________________________________________________________14
A. Les cytokines. __________________________________________________________ 14
B. Les récepteurs de cytokines.______________________________________________ 16
II. Les cytokines hématopoïétiques. _______________________________________19
A. Caractéristiques des cytokines hématopoïétiques. ____________________________ 19
B. Les récepteurs des cytokines hématopoïétiques. _____________________________ 19
1. Structure des chaînes réceptrices.________________________________________________ 19
2. Les familles de récepteurs hématopoïétiques. ______________________________________ 20
C. La transduction du signal des cytokines hématopoïétiques. ____________________ 22
LE SYSTEME IL-15 _____________________________________________________23
I. L'Interleukine-15. ___________________________________________________23
A. Caractéristiques moléculaires et biochimiques de l’IL-15 humaine. _____________ 23
1. Caractéristiques du gène et des messagers de l'IL-15. ________________________________ 23
2. Caractéristiques protéiques de l'IL-15.____________________________________________ 26
a) Forme soluble. ____________________________________________________________ 26
b) Forme membranaire. _______________________________________________________ 26
B. Sites d’expression de l’IL-15. _____________________________________________ 27
C. Régulation de l’expression de l’IL-15.______________________________________ 28
1. Régulation transcriptionnelle de l’expression de l’IL-15. _____________________________ 28
2. Régulation traductionnelle de l'expression de l'IL-15. ________________________________ 29
3. Régulation post-traductionnelle de l’expression de l’IL-15. ___________________________ 30
II. Les Récepteurs de l'IL-15.___________________________________________31
A. Le récepteur de l'IL-15 commun au récepteur de l'IL-2. ______________________ 32
1. La chaîne γc réceptrice.________________________________________________________ 32
2. La chaîne IL-2/15Rβ (CD122). _________________________________________________ 34
B. La chaîne privée du récepteur de l'IL-15 : l'IL-15Rα. ________________________ 36
1. Identification et clonage de la chaîne IL-15Rα._____________________________________ 36
2. Caractéristiques du gène et des messagers de l'IL-15Rα.______________________________ 36
3. Caractéristiques protéiques de l'IL-15Rα. _________________________________________ 37
4. Sites d'expression de l'IL-15Rα._________________________________________________ 40
5. Régulation de l'expression de l'IL-15Rα.__________________________________________ 40
- 2 -

Table des Matières
6. La chaîne réceptrice IL-15RX des mastocytes. _____________________________________ 41
C. La transduction du signal IL-15. __________________________________________ 41
1. Signalisation par le récepteur dimérique IL-2Rβ/γc et le récepteur trimérique
IL-15Rα/ IL-2Rβ/γc. _________________________________________________________ 41
a) Les kinases JAK1 et JAK3. __________________________________________________ 41
b) Les facteurs STAT3 et STAT5._______________________________________________ 42
c) Les MAPKs ERK1, JNK et p38 MAPK.________________________________________ 42
d) La PI3-K. ________________________________________________________________ 42
2. Signalisation par l'IL-15Rα.____________________________________________________ 43
3. Signalisation dans les mastocytes. _______________________________________________ 43
4. Signalisation par le récepteur hybride IL-15Rα/IL-2Rβ/βc des cellules TF-1β. ____________ 44
5. Signalisation par le récepteur IL-15Rα des cellules TF-1 et TF-1β. _____________________ 44
III. Les Fonctions Biologiques de l'IL-15. _________________________________46
A. Les fonctions biologiques de l'IL-15 dans le système immunitaire. ______________ 46
1. Les monocytes, macrophages et cellules dendritiques. _______________________________ 46
2. Les lymphocytes T. __________________________________________________________ 47
a) Les lymphocytes T à TCRαβ. ________________________________________________ 47
(1) L'homéostasie des lymphocytes T. __________________________________________ 47
(2) La prolifération de lymphocytes T.__________________________________________ 47
(3) La survie des lymphocytes T. ______________________________________________ 48
(4) La migration des lymphocytes T. ___________________________________________ 48
(5) L'activation des lymphocytes T. ____________________________________________ 48
(6) La sécrétion de cytokines par les lymphocytes T._______________________________ 48
b) Les IELs. ________________________________________________________________ 49
c) Les lymphocytes T à TCRγδ. ________________________________________________ 49
d) Les cellules NK-T._________________________________________________________ 50
3. Les lymphocytes B. __________________________________________________________ 50
4. Les cellules NK._____________________________________________________________ 50
a) Le développement des cellules NK.____________________________________________ 51
b) La migration de cellules NK. ________________________________________________ 51
c) L'activation des cellules NK._________________________________________________ 51
d) La prolifération des cellules NK. _____________________________________________ 51
e) La sécrétion de cytokines par les cellules NK. ___________________________________ 51
5. Les éosinophiles. ____________________________________________________________ 52
6. Les neutrophiles. ____________________________________________________________ 52
7. Les mastocytes. _____________________________________________________________ 52
B. Les fonctions biologiques de l'IL-15 en dehors du système immunitaire. _________ 53
IV. Les fonctions de l'IL-15 dans un contexte pathologique. __________________55
A. Les infections virales. ___________________________________________________ 55
1. Le Virus de l'Immunodéficience Humaine : VIH. ___________________________________ 55
2. Autres virus. ________________________________________________________________ 56
B. Les maladies inflammatoires._____________________________________________ 56
1. La polyarthrite rhumatoïde. ____________________________________________________ 56
2. Les maladies inflammatoires chroniques de l'intestin. ________________________________ 57
3. Les autres pathologies inflammatoires. ___________________________________________ 58
C. Le rejet de greffe. ______________________________________________________ 58
D. Les cancers. ___________________________________________________________ 59
(1) La leucémie lymphocytaire T de l'adulte. _____________________________________ 59
(2) La paraparésie spastique tropicale. __________________________________________ 59
(3) Les lymphomes cutanés T épidermotropes. ___________________________________ 59
(4) La leucémie à grands lymphocytes à grains.___________________________________ 60
(5) Les leucémies lymphocytaires B et les myélomes.______________________________ 60
(6) Les mélanomes. ________________________________________________________ 60
(7) Les autres tumeurs solides. ________________________________________________ 61
- 3 -

Table des Matières
E. Les infections microbiennes. _____________________________________________ 61
V. L'IL-15 en thérapie.__________________________________________________63
LES RECEPTEURS SOLUBLES DE CYTOKINES ___________________________65
I. Mode de production des récepteurs solubles.______________________________65
A. Mécanismes de génération d'un récepteur soluble. ___________________________ 65
1. Coupure protéolytique ________________________________________________________ 65
2. Transcription des ectodomaines des récepteurs solubles de cytokines. ___________________ 68
a) Synthèse à partir d'un épissage alternatif de l'ARN messager ________________________ 68
b) Transcription de gènes distincts codant pour des protéines solubles liant les cytokines. ___ 69
3. Mécanisme de relargage de récepteurs de cytokine par l'intermédiaire des vésicules
exosome-like. _______________________________________________________________ 69
4. Génération des récepteurs solubles de cytokines par relargage d'ectodomaines lié par une
ancre GPI. _________________________________________________________________ 70
5. Les récepteurs solubles de cytokines issus de virus. _________________________________ 70
B. Régulation de la production du récepteur soluble. ___________________________ 71
1. Activation cellulaire. _________________________________________________________ 71
2. Cytokines.__________________________________________________________________ 72
3. Autres facteurs.______________________________________________________________ 74
II. Fonctions immunorégulatrices des récepteurs solubles de cytokines. ________74
A. Effets antagonistes. _____________________________________________________ 74
(1) L'effet antagoniste est cytokine-spécifique. ___________________________________ 75
(2) L'effet antagoniste est inversement lié à la concentration de cytokine. ______________ 75
(3) L'effet antagoniste est influencé par les affinités de liaison de la cytokine pour ses
récepteurs soluble et membranaire. ______________________________________________ 75
B. Rôle de transporteur ("carrier") et effet agoniste. ___________________________ 78
(1) Accroître la stabilité de la cytokine. _________________________________________ 78
(2) Protection contre la protéolyse._____________________________________________ 78
(3) Transfert de la cytokine de son récepteur soluble vers son récepteur membranaire. ____ 78
(4) Augmentation de la 1/2 vie et diminution de la clairance. ________________________ 79
(5) Sensibilisation. _________________________________________________________ 79
III. Les propriétés des récepteurs solubles et leurs implications dans les pathologies:
cas du sIL-2R
α
. _________________________________________________________81
IV. Les formes solubles de complexes cytokine / récepteur. ___________________83
A. Le système IL-6.________________________________________________________ 83
1. α.______________________________________________________________ 83
2. Tanssignalisation. _______________________________________________________ 85
3. l' Hyper-IL-6. _______________________________________________________________ 86
4. Autres complexes cytokine/récepteur de la famille IL-6.______________________________ 88
B. La famille IL-12. _______________________________________________________ 88
1. Caractéristiques. _____________________________________________________________ 88
2. Les effets biologiques de l'IL-12.________________________________________________ 88
3. Structure du récepteur de l'IL-12.________________________________________________ 89
4. L'IL-23 et l'IL-27.____________________________________________________________ 89
V. Les récepteurs solubles de cytokines en thérapie. __________________________92
A. Récepteurs solubles comme agents thérapeutiques. __________________________ 92
1. Avantages. _________________________________________________________________ 92
2. Inconvénients. ______________________________________________________________ 93
B. Utilisation clinique et applications. ________________________________________ 93
- 4 -

Table des Matières
a) Maladies inflammatoires. ___________________________________________________ 93
b) Asthmes et allergies. _______________________________________________________ 94
c) Régulations immunitaires. ___________________________________________________ 94
d) Facteurs de croissance autocrine pour les cellules tumorales.________________________ 94
C. Observations cliniques. __________________________________________________ 94
RÉSULTATS____________________________________________________________96
AVANT PROPOS _______________________________________________________97
I. Mise en évidence d'une forme soluble de la chaîne alpha du récepteur de l'IL-15.98
A. Résumé._______________________________________________________________ 98
B. Introduction. __________________________________________________________ 99
C. Résultats. _____________________________________________________________ 99
D. Article I. _____________________________________________________________ 103
II. Effet agoniste du IL-15R
α
-sushi soluble en présence d'IL-15 sur les cellules
exprimant IL-2R
β
et
γ
c. __________________________________________________112
A. Résumé.______________________________________________________________ 112
B. Introduction. _________________________________________________________ 113
C. Résultats. ____________________________________________________________ 114
D. Article II. ____________________________________________________________ 118
III. IL-15, sIL-15R
α
, complexe IL-15/sIL-15R
α
et pathologies._______________127
A. Introduction. _________________________________________________________ 127
B. Mise en évidence d’un complexe IL-15/sIL-15Rα dans le surnageant de COS-7 double
transfectées. ______________________________________________________________ 127
1. Méthodes de détection du sIL-15Rα, de l'IL-15 et du complexe. ______________________ 127
2. Détection d’un complexe IL-15/sIL-15Rα dans les surnageants de COS-7 exprimant l’IL-15 et
l'IL-15Rα membranaire. __________________________________________________________ 129
C. Mise en Evidence du sIL-15Rα et d'IL-15 dans les sérums de patients atteints de
Maladie de Crohn. _________________________________________________________ 130
DISCUSSION _________________________________________________________133
CONCLUSION ET PERPECTIVES _______________________________________143
REFERENCES BIBLIOGRAPHIQUES _____________________________________146
ANNEXES _____________________________________________________________173
- 5 -
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
1
/
187
100%